Elektrische Doppelschicht: Unterschied zwischen den Versionen
Max G. (Diskussion | Beiträge) (Die Seite wurde neu angelegt: Die elektrische Doppelschicht ist eine Schicht von Ionen eines Metalls, das sich in Wasser bzw. einer wässrigen Lösung um das Metall herum befindet. Beim sehr langsa...) |
Max G. (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
Die elektrische Doppelschicht ist eine Schicht von Ionen eines Metalls, das sich in Wasser bzw. einer wässrigen Lösung um das Metall herum befindet. | Die elektrische Doppelschicht ist eine Schicht von Ionen eines Metalls, das sich in Wasser bzw. einer wässrigen Lösung um das Metall herum befindet. | ||
| − | Beim sehr langsamen Lösungsvorgang von Metallen in Wasser gehen Atome des Metalls in Lösung, weil ein Konzentrationsgefälle vom Metall zwischen dem Metall und dem Wasser besteht. Es bildet sich nun ein Metall-Ion <math> M^{n+} </math> und es verbleiben n Elektronen in dem Metall. Es findet also eine Oxidation statt. Um das Metall-Ion bildet sich eine Schicht von Wasser-Molekülen, da wasser ein Dipol ist. Die negative Partialladung wird von der positiven Ionenladung statisch angezogen. Es finde allerdings <u>keine Reaktion</u> statt. Die Ionen halten sich in unmittelbarer Nähe des Metalls auf, da diese eine Positive Ladung haben und das Metall aufgrund der verbliebenen Elektronen leicht Negativ geladen ist. Diese zeihen sich ebenfalls statisch an. | + | Beim sehr langsamen Lösungsvorgang von Metallen in Wasser gehen Atome des Metalls in Lösung, weil ein Konzentrationsgefälle vom Metall zwischen dem Metall und dem Wasser besteht. Es bildet sich nun ein Metall-Ion '''<math> M^{n+} </math>''' und es verbleiben n Elektronen in dem Metall. Es findet also eine Oxidation statt. Um das Metall-Ion bildet sich eine Schicht von Wasser-Molekülen, da wasser ein Dipol ist. Die negative Partialladung wird von der positiven Ionenladung statisch angezogen. Es finde allerdings <u>keine Reaktion</u> statt. Die Ionen halten sich in unmittelbarer Nähe des Metalls auf, da diese eine Positive Ladung haben und das Metall aufgrund der verbliebenen Elektronen leicht Negativ geladen ist. Diese zeihen sich ebenfalls statisch an. |
Das ganze sieht dann so aus: | Das ganze sieht dann so aus: | ||
| − | |||
| − | |||
Version vom 15. Dezember 2009, 12:57 Uhr
Die elektrische Doppelschicht ist eine Schicht von Ionen eines Metalls, das sich in Wasser bzw. einer wässrigen Lösung um das Metall herum befindet.
Beim sehr langsamen Lösungsvorgang von Metallen in Wasser gehen Atome des Metalls in Lösung, weil ein Konzentrationsgefälle vom Metall zwischen dem Metall und dem Wasser besteht. Es bildet sich nun ein Metall-Ion 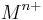 und es verbleiben n Elektronen in dem Metall. Es findet also eine Oxidation statt. Um das Metall-Ion bildet sich eine Schicht von Wasser-Molekülen, da wasser ein Dipol ist. Die negative Partialladung wird von der positiven Ionenladung statisch angezogen. Es finde allerdings keine Reaktion statt. Die Ionen halten sich in unmittelbarer Nähe des Metalls auf, da diese eine Positive Ladung haben und das Metall aufgrund der verbliebenen Elektronen leicht Negativ geladen ist. Diese zeihen sich ebenfalls statisch an.
und es verbleiben n Elektronen in dem Metall. Es findet also eine Oxidation statt. Um das Metall-Ion bildet sich eine Schicht von Wasser-Molekülen, da wasser ein Dipol ist. Die negative Partialladung wird von der positiven Ionenladung statisch angezogen. Es finde allerdings keine Reaktion statt. Die Ionen halten sich in unmittelbarer Nähe des Metalls auf, da diese eine Positive Ladung haben und das Metall aufgrund der verbliebenen Elektronen leicht Negativ geladen ist. Diese zeihen sich ebenfalls statisch an.
Das ganze sieht dann so aus:

