Quantitative Redoxreihe: Unterschied zwischen den Versionen
Hafner (Diskussion | Beiträge) |
|||
| (2 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 11: | Zeile 11: | ||
Daraus ergibt sich die '''Spannungsreihe der Metalle''': | Daraus ergibt sich die '''Spannungsreihe der Metalle''': | ||
| − | + | ''' | |
| − | + | Bild gelöscht!''' | |
Anhand der Standard-Elektronen-Potentiale können wir nun die Zellspannung jeder beliebigen galvanischen Zelle ([[Galvanische Zelle]]) unter Standardbedingungen bestimmen.<br /> | Anhand der Standard-Elektronen-Potentiale können wir nun die Zellspannung jeder beliebigen galvanischen Zelle ([[Galvanische Zelle]]) unter Standardbedingungen bestimmen.<br /> | ||
| Zeile 19: | Zeile 19: | ||
<math>U=\Delta E = E^\circ(Akzeptor-Halbzelle) - E^\circ (Donator-Halbzelle) </math> | <math>U=\Delta E = E^\circ(Akzeptor-Halbzelle) - E^\circ (Donator-Halbzelle) </math> | ||
| + | |||
| + | Das Standard-Elektroden-Potential ist also ein quantitatives Maß für die Neigung der Metall-Atome, als Elektronen-Donatoren zu wirken.<br /> | ||
| + | |||
| + | |||
| + | === Literaturverzeichnis === | ||
| + | |||
| + | ---- | ||
| + | |||
| + | [1] Tausch, Michael: ''Chemie SII. Stoff - Formel - Umwelt'', Aus: C.C.Buchner, Bamberg 2008, S. 176-178 | ||
Aktuelle Version vom 13. Februar 2012, 14:27 Uhr
Bei der Kombination zweier beliebiger Redoxpaare kann immer eine spezifische Spannung gemessen werden, die sogenannte Potentialdifferenz.
Dabei gilt: Je weiter die Redoxpaare in der Redoxreihe auseinanderstehen, desto größer ist die Spannung zwischen den betreffenden Halbzellen.
Außerdem lassen sich entsprechende Spannungen addieren, d.h. die Spannung einer Zink-Silber-Zelle entspricht den Spannungen für die Zink-Blei und die Blei-Silber-Zelle
Jedem Redoxpaar kann ein spezifischer Potential-Wert in Bezug auf ein bestimmtes Redoxpaar zugeordnet werden.
Diesen Bezugspunkt stellt die Standard-Wasserstoff-Halbzelle dar.
Die unter Standard-Bedingungen gemessene Potentialdifferenz zwischen einer beliebigen Halbzelle und der Standard-Wasserstoff-Halbzelle bezeichnet man als Standard-Elektroden-Potential oder Normalpotential.
Redoxpaare, die gegenüber der Standard-Wasserstoff-Halbzelle den elektrisch negativen Pol bilden, erhalten einen negativen Potentialwert, wobei Redoxpaaren, die gegenüber der Standard-Wasserstoff-Halbzelle den elektrisch positiven Pol bilden, ein positiver Potentialwert zugeordnet wird.
Daraus ergibt sich die Spannungsreihe der Metalle: Bild gelöscht!
Anhand der Standard-Elektronen-Potentiale können wir nun die Zellspannung jeder beliebigen galvanischen Zelle (Galvanische Zelle) unter Standardbedingungen bestimmen.
Die Zellspannung U ergibt sich aus der Differenz der Standard-Elektroden-Potentiale:
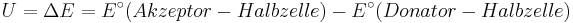
Das Standard-Elektroden-Potential ist also ein quantitatives Maß für die Neigung der Metall-Atome, als Elektronen-Donatoren zu wirken.
Literaturverzeichnis
[1] Tausch, Michael: Chemie SII. Stoff - Formel - Umwelt, Aus: C.C.Buchner, Bamberg 2008, S. 176-178

