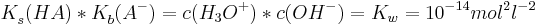Formelsammlung: Unterschied zwischen den Versionen
Aus KAS-Wiki
(→pH-Wert, pOH-Wert und Beziehungen) |
(→Säurekonstanten und Basekonstanten) |
||
| (7 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 28: | Zeile 28: | ||
=== Säurekonstanten und Basekonstanten === | === Säurekonstanten und Basekonstanten === | ||
Die Säurekonstante <math>K_{s}^{ }</math> ist definiert als <br /><br /> | Die Säurekonstante <math>K_{s}^{ }</math> ist definiert als <br /><br /> | ||
| − | <math>K_{s}^{ }=c(H_{2}O)*K=\frac {c(H_{3}O^{+})*c(A^{-}}{c(HA)}</math> | + | <math>K_{s}^{ }=c(H_{2}O)*K=\frac {c(H_{3}O^{+})*c(A^{-})}{c(HA)}</math><br /><br /> |
| + | und ebenso gilt analog für die Basekonstante <br /><br /> | ||
| + | <math>K_{b}^{ }=c(H_{2}O)*K=\frac {c(OH^{-})*c(BH^{+})}{c(B)}</math><br /><br /> | ||
| + | wobei alle Konzentrationen auf das Gleichgewicht bezogen sind.<br /><br /> | ||
| + | Man definiert weiter den <math>pK_{s}^{ }</math>-Wert als <br /><br /> | ||
| + | <math>pK_{s}^{ }=-\lg K_{s}</math><br /><br /> | ||
| + | und den <math>pK_{b}^{ }</math>-Wert als <br /><br /> | ||
| + | <math>pK_{b}^{ }=-\lg K_{b}</math><br /><br /> | ||
| + | und erhält auch hier die Beziehung <br /><br /> | ||
| + | <math>pK_{s}^{ }(HA)+pK_{b}(A^{-})=14</math><br /><br /> | ||
| + | und<br /><br /> | ||
| + | <math>K^{ }_{s}(HA)*K^{ }_{b}(A^{-})=c(H_{3}O^{+})*c(OH^{-})=K_{w}=10^{-14}mol^{2}l^{-2}</math><br /><br /> | ||
Aktuelle Version vom 11. April 2010, 13:52 Uhr
Inhaltsverzeichnis[Verbergen] |
Potentiometrie
Sei 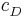 die Konzentration in der Donator-Halbzelle, dessen Konzentration bestimmt werden soll. Dann gilt
die Konzentration in der Donator-Halbzelle, dessen Konzentration bestimmt werden soll. Dann gilt
wobei 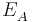 das vorher bestimme Elektrodenpotential der Akzeptorhalbzelle ist und
das vorher bestimme Elektrodenpotential der Akzeptorhalbzelle ist und 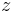 die Elektronenübertragungszahl.
die Elektronenübertragungszahl.
Herleitung
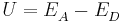
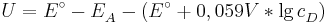
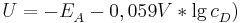
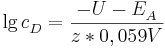
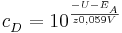
pH-Wert, pOH-Wert und Beziehungen
Für die Definition des pH-Wertes gilt
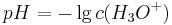
und es gilt analog
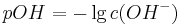
wobei sich folgende Beziehung ergibt
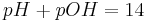
Dies folgt nämlich aus der Tatsache, dass für das Ionenprodukt des Wassers gilt
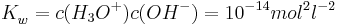
und dem Anwenden der Logarithmus-Gesetze.
Säurekonstanten und Basekonstanten
Die Säurekonstante 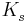 ist definiert als
ist definiert als
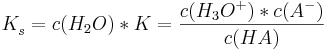
und ebenso gilt analog für die Basekonstante
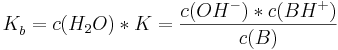
wobei alle Konzentrationen auf das Gleichgewicht bezogen sind.
Man definiert weiter den 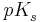 -Wert als
-Wert als
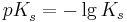
und den 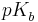 -Wert als
-Wert als
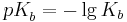
und erhält auch hier die Beziehung
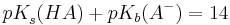
und