PKs und pKb-Wert: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: Bei dem pK<sub>s</sub> und dem pK<sub>b</sub> handelt es sich um Werte, die angeben wie stark eine Säure oder Base ist. Jede Säure hat einen charakteristischen pK<sub...) |
|||
| (Eine dazwischenliegende Version von einem Benutzer wird nicht angezeigt) | |||
| Zeile 4: | Zeile 4: | ||
<math>pK_{b} = -lg(K_{b})</math><br /> | <math>pK_{b} = -lg(K_{b})</math><br /> | ||
Addiert man die beiden Werte(pK<sub>s</sub> und pK<sub>b</sub>) eines Säure/konjugierte Base-Paars, ergeben diese immer eine Summe von 14. | Addiert man die beiden Werte(pK<sub>s</sub> und pK<sub>b</sub>) eines Säure/konjugierte Base-Paars, ergeben diese immer eine Summe von 14. | ||
| − | Dies lässt sich mit den Gleichungen für den K<sub> | + | Dies lässt sich mit den Gleichungen für den K<sub>s</sub>- und den K<sub>b</sub>-Wert erklären, von denen pK<sub>b</sub> und pK<sub>s</sub> abhängen.<br /> |
| − | + | <math>K_{s}(HA) = \frac{c(H_{3}0^{+})*c(A^{-})} {c(HA)}</math><br /> | |
| − | + | <math>K_{b}(A^{-}) = \frac{c(OH^{-})*c(HA)} {c(A^{-})}</math><br /> | |
| − | Multipliziert man diese beiden Gleichungen, kommt man nach Kürzung auf folgende Gleichung: | + | Multipliziert man diese beiden Gleichungen, kommt man nach Kürzung auf folgende Gleichung:<br /> |
| − | + | <math>K_{s}(HA)*K_{b}(A-) = c(H_{3}O^{+})*c(OH^{-})</math><br /> | |
| − | Diese Gleichung entspricht wiederum der Wasserkonstanten | + | Diese Gleichung entspricht wiederum der Wasserkonstanten K<sub>w</sub>, welche bei Raumtemperatur immer 10<sup>-14</sup> Mol<sup>2</sup> *l<sup>-2</sup> beträgt.<br /> |
| − | Dementsprechend: | + | Dementsprechend:<br /> |
| − | + | <math>K_{s}*K_{b} = 10^{-14} Mol^{2}*l^{-2}</math><br /> | |
| − | Durch die Anwendung des negativen dekadischen Logarithmus und der Definition des | + | Durch die Anwendung des negativen dekadischen Logarithmus und der Definition des pK<sub>b</sub> und pK<sub>s</sub>-Wertes kommt man somit auf die Gleichung: |
| − | pKs + pKb = 14 | + | pKs + pKb = 14<br /> |
| − | Da eine starke Säure einen hohen Ks-Wert hat, ist der pKs-Wert einer starken Säuren entsprechend gering und umgekehrt. Dies | + | Da eine starke Säure einen hohen Ks-Wert hat, ist der pKs-Wert einer starken Säuren entsprechend gering und umgekehrt.<br /> |
| + | Hierbei gibt es folgende Einstufungen:<br /> | ||
| + | pK<sub>s</sub><1,5 -> Starke Säure<br /> | ||
| + | 1,5<pK<sub>s</sub><4,75 -> Mittelstarke Säure<br /> | ||
| + | pK<sub>s</sub>>4,75 -> Schwache Säure<br /><br /> | ||
| + | Dies Gilt Analog für den pK<sub>b</sub> und die Basenstärke.<br /> | ||
| + | Generell kann jede Verbindung mit einem pK<sub>s</sub> oder pK<sub>b</sub> unter 14 dementsprechend sauer, bzw. basisch reagieren. Liegen bei einem Säure/konjugierte Base paar beide Werte in diesem Bereich, spricht man von einem Ampholyt, ein Stoff der sowohl sauer, als auch basisch reagieren kann. | ||
Aktuelle Version vom 18. April 2010, 14:47 Uhr
Bei dem pKs und dem pKb handelt es sich um Werte, die angeben wie stark eine Säure oder Base ist. Jede Säure hat einen charakteristischen pKs Wert, während jede Base einen charakteristischen pKb hat.
Diese Werte definieren sich jeweils über den negativen dekadischen Logarithmus der Ks- und Kb-Werte.
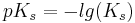
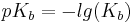
Addiert man die beiden Werte(pKs und pKb) eines Säure/konjugierte Base-Paars, ergeben diese immer eine Summe von 14.
Dies lässt sich mit den Gleichungen für den Ks- und den Kb-Wert erklären, von denen pKb und pKs abhängen.
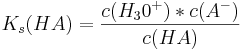
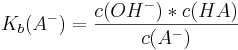
Multipliziert man diese beiden Gleichungen, kommt man nach Kürzung auf folgende Gleichung:
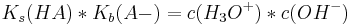
Diese Gleichung entspricht wiederum der Wasserkonstanten Kw, welche bei Raumtemperatur immer 10-14 Mol2 *l-2 beträgt.
Dementsprechend:
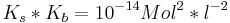
Durch die Anwendung des negativen dekadischen Logarithmus und der Definition des pKb und pKs-Wertes kommt man somit auf die Gleichung:
pKs + pKb = 14
Da eine starke Säure einen hohen Ks-Wert hat, ist der pKs-Wert einer starken Säuren entsprechend gering und umgekehrt.
Hierbei gibt es folgende Einstufungen:
pKs<1,5 -> Starke Säure
1,5<pKs<4,75 -> Mittelstarke Säure
pKs>4,75 -> Schwache Säure
Dies Gilt Analog für den pKb und die Basenstärke.
Generell kann jede Verbindung mit einem pKs oder pKb unter 14 dementsprechend sauer, bzw. basisch reagieren. Liegen bei einem Säure/konjugierte Base paar beide Werte in diesem Bereich, spricht man von einem Ampholyt, ein Stoff der sowohl sauer, als auch basisch reagieren kann.

