Nickel-Cadmium/Metallhydrid-Akkumulator: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: Der bis Ende der 1990er Jahre am stärksten verbreitete Nickel-Cadmium-Akkumulator wurde zunehmend durch den Nickel-Metallhydrid-Akkumulator verdrängt.<br /> Dieser ze...) |
K (hat „Nickel-Cadmium/Metallhydrid Akkumulator“ nach „Nickel-Cadmium/Metallhydrid-Akkumulator“ verschoben: RS) |
||
| (15 dazwischenliegende Versionen von einem Benutzer werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Der bis Ende der 1990er Jahre am stärksten verbreitete Nickel-Cadmium-Akkumulator wurde zunehmend durch den Nickel-Metallhydrid-Akkumulator verdrängt.<br /> | + | Der bis Ende der 1990er Jahre am stärksten verbreitete '''Nickel-Cadmium-Akkumulator''' wurde zunehmend durch den '''Nickel-Metallhydrid-Akkumulator''' verdrängt.<br /> |
| − | Dieser zeichnet sich dadurch aus, dass er mit weniger umweltschädlichen und giftigen Materialien auskommt und gleichzeitig eine höhere Energiedichte und Effizienz aufweist.<br /> | + | Dieser zeichnet sich dadurch aus, dass er mit weniger umweltschädlichen und giftigen Materialien auskommt und<br /> |
| + | gleichzeitig eine höhere Energiedichte und Effizienz aufweist.<br /> | ||
Trotz alledem hat aber auch der Nickel-Cadmium-Akkumulator noch eine eindeutige Existenzberechtigung durch seine Fähigkeit kurzfristig mehr Energie zu liefern.<br /> | Trotz alledem hat aber auch der Nickel-Cadmium-Akkumulator noch eine eindeutige Existenzberechtigung durch seine Fähigkeit kurzfristig mehr Energie zu liefern.<br /> | ||
| − | + | <br /> | |
=== Nickel-Cadmium-Akkumulator === | === Nickel-Cadmium-Akkumulator === | ||
| + | Am Minuspol des NCA wird fein verteiltes Cadmiumpulver verwendet. Dieses haftet am Anfang an der Plattenelektrode. Im geladenen Zustand befindet sich <br /> | ||
| + | Nickel(III)-oxidhydroxidam Pluspol des Akkumulators.<br /><br /> | ||
| + | Man kann hier die gelieferte Stromstärke erhöhen, indem man die Reaktionsoberfläche an den Elektroden erhöht, was durch den Einsatz von pulverförmigen<br /> | ||
| + | Aktivmassen an den Elektroden geschieht. So kann man die Zahl der Formelumsätze deutlich erhöhen und die Zahl der übertragenen Elektronen pro Zeitintervall erhöhen.<br /> | ||
| + | Als Elektroly wird hierbei normalerweise eine 20%-ige Kaliumhydroxidlösung verwendet.<br /><br /> | ||
| + | Enlädt man nun den Akkumulator, so spielen sich folgenden Reaktionen ab:<br /> | ||
| + | <br /> | ||
| + | Anode: <math>Cd_{(s)}+2OH^{-}_{(aq)} \rightarrow Cd(OH)_{2(s)}+2e^{-}</math><br /> | ||
| + | Kathode: <math>2NiO(OH)_{(s)}+2H_{2}O{(l)}+2e^{-} \rightarrow 2Ni(OH)_{2(s)}+2OH^{-}_{(aq)}</math><br /> | ||
| + | <br /> | ||
| + | Legt man nun eine ausreichend große Spannung an, so kann man die Reaktion umkehren und den Akku wieder aufladen.<br /> | ||
| + | <br /> | ||
| + | Der NCA ist wie man schon in der Reaktion erkennen kann mit dem hochgiftigen Schwermetall Cadmium ausgestattet. Deswegen besteht auch eine hohe <br /> | ||
| + | Notwendigkeit zum Recycling der verbrauchten NCA.<br /> | ||
| + | <br /> | ||
| + | |||
| + | === Metallhydrid-Akkumulator === | ||
| + | |||
| + | Im Gegensatz zum NCA und fast allen anderen elektrochemischen Systemen, die normalerweise Feststoffe wie Zink oder Cadmium verwenden, wird hier <br /> | ||
| + | von gasförmigem Wasserstoff gebrauch gemacht.<br /> | ||
| + | <br /> | ||
| + | Dieser wird unter hohem Druck in einer Metallegierung gespeichert und so kann der Metallhydrid-Akkumulator das bis zu Tausendfache <br /> | ||
| + | des eigentlich zu Speicherung benötigten Volumens aufnehmen. <br /> | ||
| + | <br /> | ||
| + | Das Metallhydrid, wie eine Metallegierung mit eingelagertem Wasserstoff genannt wird, bildet nun den Minuspol.<br /> | ||
| + | Der Pluspol ist hierbei ansonsten identisch mit dem des Nickel-Cadmium-Akkumulator.<br /> | ||
| + | <br /> | ||
Aktuelle Version vom 4. August 2010, 15:55 Uhr
Der bis Ende der 1990er Jahre am stärksten verbreitete Nickel-Cadmium-Akkumulator wurde zunehmend durch den Nickel-Metallhydrid-Akkumulator verdrängt.
Dieser zeichnet sich dadurch aus, dass er mit weniger umweltschädlichen und giftigen Materialien auskommt und
gleichzeitig eine höhere Energiedichte und Effizienz aufweist.
Trotz alledem hat aber auch der Nickel-Cadmium-Akkumulator noch eine eindeutige Existenzberechtigung durch seine Fähigkeit kurzfristig mehr Energie zu liefern.
Nickel-Cadmium-Akkumulator
Am Minuspol des NCA wird fein verteiltes Cadmiumpulver verwendet. Dieses haftet am Anfang an der Plattenelektrode. Im geladenen Zustand befindet sich
Nickel(III)-oxidhydroxidam Pluspol des Akkumulators.
Man kann hier die gelieferte Stromstärke erhöhen, indem man die Reaktionsoberfläche an den Elektroden erhöht, was durch den Einsatz von pulverförmigen
Aktivmassen an den Elektroden geschieht. So kann man die Zahl der Formelumsätze deutlich erhöhen und die Zahl der übertragenen Elektronen pro Zeitintervall erhöhen.
Als Elektroly wird hierbei normalerweise eine 20%-ige Kaliumhydroxidlösung verwendet.
Enlädt man nun den Akkumulator, so spielen sich folgenden Reaktionen ab:
Anode: 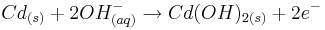
Kathode: 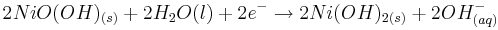
Legt man nun eine ausreichend große Spannung an, so kann man die Reaktion umkehren und den Akku wieder aufladen.
Der NCA ist wie man schon in der Reaktion erkennen kann mit dem hochgiftigen Schwermetall Cadmium ausgestattet. Deswegen besteht auch eine hohe
Notwendigkeit zum Recycling der verbrauchten NCA.
Metallhydrid-Akkumulator
Im Gegensatz zum NCA und fast allen anderen elektrochemischen Systemen, die normalerweise Feststoffe wie Zink oder Cadmium verwenden, wird hier
von gasförmigem Wasserstoff gebrauch gemacht.
Dieser wird unter hohem Druck in einer Metallegierung gespeichert und so kann der Metallhydrid-Akkumulator das bis zu Tausendfache
des eigentlich zu Speicherung benötigten Volumens aufnehmen.
Das Metallhydrid, wie eine Metallegierung mit eingelagertem Wasserstoff genannt wird, bildet nun den Minuspol.
Der Pluspol ist hierbei ansonsten identisch mit dem des Nickel-Cadmium-Akkumulator.

