Ur-Batterie/Bagdad-Batterie: Unterschied zwischen den Versionen
Hafner (Diskussion | Beiträge) |
|||
| (5 dazwischenliegende Versionen von 3 Benutzern werden nicht angezeigt) | |||
| Zeile 4: | Zeile 4: | ||
| − | + | '''Bild entfernt''' | |
Es handelt sich hierbei um ein galvanisches Element mit einer Wasserstoff- und einer Eisenelektrode. | Es handelt sich hierbei um ein galvanisches Element mit einer Wasserstoff- und einer Eisenelektrode. | ||
| Zeile 23: | Zeile 23: | ||
<math>Fe(s) + 2H_{3}0^{+}(aq) \rightarrow Fe^{2+}(aq) + 2H_{2}0(l) + H_{2}(g)</math> | <math>Fe(s) + 2H_{3}0^{+}(aq) \rightarrow Fe^{2+}(aq) + 2H_{2}0(l) + H_{2}(g)</math> | ||
| − | So entsteht eine [[Redoxreihe | + | So entsteht eine [[Quantitative Redoxreihe|Potientialdifferenz]] von 0,41V zwischen den Redoxpaaren Eisen und Wasserstoff. |
Fe/Fe<sup>2+</sup>//2H<sub>3</sub>O<sup>+</sup>/2H<sub>2</sub>O+H<sub>2</sub> | Fe/Fe<sup>2+</sup>//2H<sub>3</sub>O<sup>+</sup>/2H<sub>2</sub>O+H<sub>2</sub> | ||
Aktuelle Version vom 13. Februar 2012, 14:32 Uhr
Die Bagdad-Batterie, auch Batterie der Parther genannt, ist der älteste bekannte Fund von einem galvanischem Element. Es handelt sich hierbei um ein im Jahre 1936 von Wilhelm König entdecktes Tongefäß, welches schon vor 2000 Jahren als Batterie gedient haben könnte. Bei Ausgrabungen an dem Hügel Khujut Rabuah in der Nähe von Bagdad, Irak, stieß er auf die als erste Batterie bekannte Konstruktion.
Bild entfernt
Es handelt sich hierbei um ein galvanisches Element mit einer Wasserstoff- und einer Eisenelektrode. Da man nicht weiß, was für ein Elektrolyt benutzt wurde, geht man von der Benutzung von Fruchtsäuren aus.
Reaktionen:
Oxidation(Anode):
An der Eisenanode oxidieren Eisenatome zu Eisen(II)-Ionen und gehen in Lösung
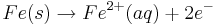
Reduktion(Kathode):
Die Elektronen wandern über den Verbraucher in das Kupferrohr, wo sie Oxonium-Ionen aus der sauren Lösung zu Wasser und Wasserstoff reduzieren
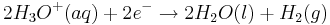
Redoxreaktion:
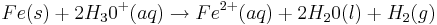
So entsteht eine Potientialdifferenz von 0,41V zwischen den Redoxpaaren Eisen und Wasserstoff. Fe/Fe2+//2H3O+/2H2O+H2
Aufgrund der geringen Spannung und Lebensdauer der Konstruktion als Batterie, ist unklar wozu sie verwendet wurde.
Die Verwendungsmöglichkeiten als Stromquelle zur Vergoldung und Beleuchtung werden wegen der geringen Spannung ausgeschlossen.

