PH-Wert Abhängigkeit von Redoxsystemen: Unterschied zwischen den Versionen
| Zeile 24: | Zeile 24: | ||
<br /> | <br /> | ||
<math>E = 1,51V + 0,012V \lg \frac {1*(10^{-1})^{8}}{1} = 1,46V</math> | <math>E = 1,51V + 0,012V \lg \frac {1*(10^{-1})^{8}}{1} = 1,46V</math> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | Man sieht nun, dass sich das Potential um <math>\Delta E = 0,24 V </math> verändert hat. | ||
Version vom 15. Dezember 2009, 13:25 Uhr
Das Elektrodenpotential von Redoxpaaren in sauren oder basischen Millieus hängt zusätzlich noch von dem pH-Wert des Redoxsystems ab.
Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential kann man ebenfalls durch die Nernst-Gleichung aufzeigen.
Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu:
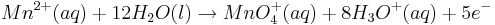
Steigt nun in diesem Beispiel die Konzentration der Oxonium-Ionen, so wird auch das Elektrodenpotential des Redoxpaares 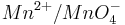 steigen.
steigen.
Denn formuliert man für dieses Redoxpaar die Nernst-Gleichung, so ergibt sich:
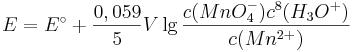
Setzt man nun voraus, dass die Konzentration der 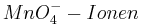 und die Konzentration der
und die Konzentration der 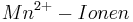 konstant bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:
konstant bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:
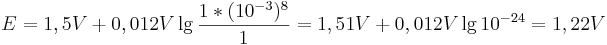
Vergleicht man diesen Wert mit einer Reaktion bei pH-Wert 1, so ergibt sich nach der Nernst-Gleich ein Potential von:
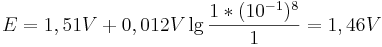
Man sieht nun, dass sich das Potential um 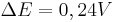 verändert hat.
verändert hat.

