Säure-Base-Puffer: Unterschied zwischen den Versionen
Aus KAS-Wiki
(Die Seite wurde neu angelegt: Wiederholt sollte man: pKs und pKb-Wert <br /> <br /> Säure-Base-Puffer oder Puffersysteme sind Lösungen, die bei Zugabe von Säure oder Base ih...) |
|||
| Zeile 9: | Zeile 9: | ||
<math>K_{s}^{ }=\frac {c(H_{3}O^{+})*c(A^{-})}{c(HA)}</math><br /><br /> | <math>K_{s}^{ }=\frac {c(H_{3}O^{+})*c(A^{-})}{c(HA)}</math><br /><br /> | ||
<br /> | <br /> | ||
| − | + | <br /><br /> | |
Ein Beispiel: <br /> | Ein Beispiel: <br /> | ||
CH<sub>3</sub>COOH + H<sub>2</sub>O <-> CH<sub>3</sub>COO<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> <br /> | CH<sub>3</sub>COOH + H<sub>2</sub>O <-> CH<sub>3</sub>COO<sup>-</sup> + H<sub>3</sub>O<sup>+</sup> <br /> | ||
Die Puffergleichung (Henderson-Hasselbach-Gleichung)<br /> | Die Puffergleichung (Henderson-Hasselbach-Gleichung)<br /> | ||
Version vom 18. April 2010, 21:21 Uhr
Wiederholt sollte man: pKs und pKb-Wert
Säure-Base-Puffer oder Puffersysteme sind Lösungen, die bei Zugabe von Säure oder Base ihren pH-Wert nur geringfügig ändern.
Ein Puffer besteht in der Regel aus einem Gemisch einer schwachen Säure und ihren konjugierten Base oder aus einer schwachen Base und ihren konjugierten Säure.
pH einer Pufferlösung
PH-Wert einer Pufferlösung lässt sich durch Protolyse-Gleichgewicht berechnet werden.
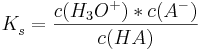
Ein Beispiel:
CH3COOH + H2O <-> CH3COO- + H3O+
Die Puffergleichung (Henderson-Hasselbach-Gleichung)

