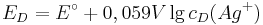Nernst-Gleichung: Unterschied zwischen den Versionen
(→Herleitung der Nernst-Gleichung) |
(→Herleitung der Nernst-Gleichung) |
||
| Zeile 35: | Zeile 35: | ||
<br /> | <br /> | ||
wobei <math>c_A</math> die Konzentration in der Donator-Halbzelle angibt und <math>c_D</math> die Konzentration in der Donator-Halbzelle. | wobei <math>c_A</math> die Konzentration in der Donator-Halbzelle angibt und <math>c_D</math> die Konzentration in der Donator-Halbzelle. | ||
| − | Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass | + | Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass die Zellspannung die Differenz der einzelnen Elektroden-Potentiale der Halbzellen ist: |
<br /> | <br /> | ||
<br /> | <br /> | ||
<math> U = E_{A} - E_{D} = 0,059 V\lg\frac{c_{A}(Ag^{+})}{c_{D}(Ag^{+})} </math> | <math> U = E_{A} - E_{D} = 0,059 V\lg\frac{c_{A}(Ag^{+})}{c_{D}(Ag^{+})} </math> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | Unter der Annahme, dass es sich bei der Akzeptor-Halbzelle um eine Standard-Halbzelle handelt und somit auch <math>E_{A} = 0,80 V</math> ist, kann man die Gleichung weiter vereinfachen: | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <math> U = E^\circ - E_{D} = 0,059 V\lg\frac{1 mol/l}{c_{D}(Ag^{+})} </math> | ||
| + | <br /> | ||
| + | Was nach umformen folgende Gleichung liefert: | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <math> E_{D} = E^\circ + 0,059 V\lg {{c_{D}(Ag^{+})}} </math> | ||
Version vom 14. Dezember 2009, 18:12 Uhr
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren:
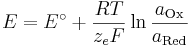
Unter Standardbedingungen vereinfacht sich die Nernst-Gleichung und man betrachtet nur noch die Abhängigkeit von der Konzentration.
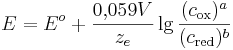
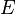 Elektrodenpotential
Elektrodenpotential
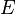 ° Standardelektronenpotential
° Standardelektronenpotential
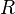 molare Gaskonstante
molare Gaskonstante
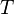 Temperatur in Kelvin
Temperatur in Kelvin
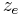 Anzahl der übertragenen Elektronen
Anzahl der übertragenen Elektronen
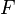 Faraday-Konstante
Faraday-Konstante
Herleitung der Nernst-Gleichung
Am Beispiel einer Konzentrationszelle aus einer Standard-Silber-Halbzelle und einer Silberhalbzelle mit unterschiedlichen Konzentrationen lässt sich die Nernst-Gleichung in einfacher Form ableiten.
Variiert man nämlich die Konzentration der Nicht-Standard-Silberzelle und misst die resultierende Spannung, kann man die Messreihe mit Hilfe der Logarithmus-Funktion linearisieren:
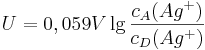
wobei 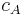 die Konzentration in der Donator-Halbzelle angibt und
die Konzentration in der Donator-Halbzelle angibt und 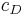 die Konzentration in der Donator-Halbzelle.
Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass die Zellspannung die Differenz der einzelnen Elektroden-Potentiale der Halbzellen ist:
die Konzentration in der Donator-Halbzelle.
Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass die Zellspannung die Differenz der einzelnen Elektroden-Potentiale der Halbzellen ist:
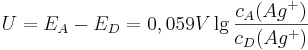
Unter der Annahme, dass es sich bei der Akzeptor-Halbzelle um eine Standard-Halbzelle handelt und somit auch 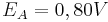 ist, kann man die Gleichung weiter vereinfachen:
ist, kann man die Gleichung weiter vereinfachen:
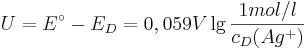
Was nach umformen folgende Gleichung liefert: