Redoxreihe der Metalle: Unterschied zwischen den Versionen
(→Einführung) |
|||
| Zeile 1: | Zeile 1: | ||
== Einführung== | == Einführung== | ||
| + | |||
| + | Wie edel oder unedel ein Metall ist, hängt von seiner Tendenz, in Redoxreaktionen Elektronen abzugeben, ab. | ||
| + | Je nach Reaktionspartner kann ein Metall-Ion sowohl ein Reduktionsmittel sein, das oxidiert wird, als auch ein Oxidationsmittel, das reduziert wird. | ||
| + | Das System aus Reduktor und dem analogen Oxidator wird als '''korrespondierendes Redoxpaar''' bezeichnet. | ||
| + | |||
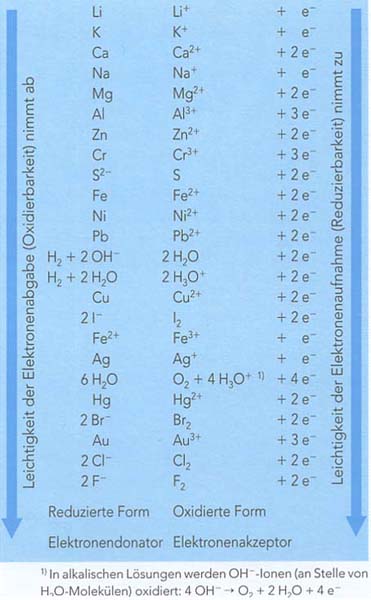
| + | Ordnet man nun alle korrespondierenden Reedoxpaare entweder nach dem Reduktionsvermögen der Metall-Atome oder dem Oxidationsvermögen der Metall-Ionen, erhält man diese Reihenfolge: | ||
| + | |||
| + | [[Bild:redoxreihe.jpg]] | ||
| + | |||
| + | Am oberen Ende der Redoxreihe sind die Metalle zu finden, welche die stärksten Elektronen-Donatoren sind. | ||
| + | Analog dazu finden sich am unteren Ende der Reihe die Edelmetalle, welche die stärksten Elektronen-Akzeptoren sind. | ||
Version vom 15. Dezember 2009, 12:38 Uhr
Einführung
Wie edel oder unedel ein Metall ist, hängt von seiner Tendenz, in Redoxreaktionen Elektronen abzugeben, ab. Je nach Reaktionspartner kann ein Metall-Ion sowohl ein Reduktionsmittel sein, das oxidiert wird, als auch ein Oxidationsmittel, das reduziert wird. Das System aus Reduktor und dem analogen Oxidator wird als korrespondierendes Redoxpaar bezeichnet.
Ordnet man nun alle korrespondierenden Reedoxpaare entweder nach dem Reduktionsvermögen der Metall-Atome oder dem Oxidationsvermögen der Metall-Ionen, erhält man diese Reihenfolge:
Am oberen Ende der Redoxreihe sind die Metalle zu finden, welche die stärksten Elektronen-Donatoren sind. Analog dazu finden sich am unteren Ende der Reihe die Edelmetalle, welche die stärksten Elektronen-Akzeptoren sind.