PH-Wert Abhängigkeit von Redoxsystemen: Unterschied zwischen den Versionen
Aus KAS-Wiki
| Zeile 12: | Zeile 12: | ||
<br /> | <br /> | ||
<math>E = E^\circ + \frac {0,059}{5} V \lg \frac {c(MnO^{-}_{4})c^{8}(H_{3}O^{+})}{c(Mn^{2+})}</math> | <math>E = E^\circ + \frac {0,059}{5} V \lg \frac {c(MnO^{-}_{4})c^{8}(H_{3}O^{+})}{c(Mn^{2+})}</math> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | Setzt man nun voraus, dass die Konzentration der <math> MnO^{-}_{4}-Ionen </math> und die Konzentration der <math>Mn^{2+}-Ionen </math> konstant bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential: <br /> | ||
| + | <br /> | ||
Version vom 15. Dezember 2009, 13:17 Uhr
Das Elektrodenpotential von Redoxpaaren in sauren oder basischen Millieus hängt zusätzlich noch von dem pH-Wert des Redoxsystems ab.
Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential kann man ebenfalls durch die Nernst-Gleichung aufzeigen.
Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu:
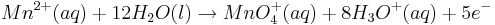
Steigt nun in diesem Beispiel die Konzentration der Oxonium-Ionen, so wird auch das Elektrodenpotential des Redoxpaares 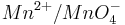 steigen.
steigen.
Denn formuliert man für dieses Redoxpaar die Nernst-Gleichung, so ergibt sich:
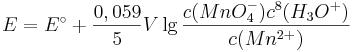
Setzt man nun voraus, dass die Konzentration der 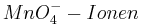 und die Konzentration der
und die Konzentration der 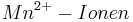 konstant bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:
konstant bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:

