Voltasche Säule: Unterschied zwischen den Versionen
| Zeile 14: | Zeile 14: | ||
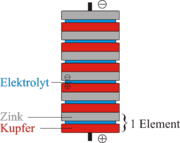
Auf eine Zinkplatte folgt ein mit Schwefelsäure getränkter Filz, worauf eine Kupferplatte folgt. | Auf eine Zinkplatte folgt ein mit Schwefelsäure getränkter Filz, worauf eine Kupferplatte folgt. | ||
Bis zu 20 dieser Elemente werden aufeinandergestapelt um die Spannung zu erhöhen. | Bis zu 20 dieser Elemente werden aufeinandergestapelt um die Spannung zu erhöhen. | ||
| − | Da die Spannung während des Betriebes sinkt, und die Zink-Platten in der | + | Da die Spannung während des Betriebes sinkt, und die Zink-Platten in der Schwefelsäure sehr schnell zersetzt werden, hat das Volta-Element nur noch historische Bedeutung. |
[[Bild:Schematischer Aufbau der Voltaschen Säule.png]] | [[Bild:Schematischer Aufbau der Voltaschen Säule.png]] | ||
<br /><br /><br /> | <br /><br /><br /> | ||
[[Kategorie:Elektrochemie]] | [[Kategorie:Elektrochemie]] | ||
Aktuelle Version vom 17. Dezember 2009, 12:18 Uhr
Das Volta Element - eine historische Spannungsquelle
Das Volta-Element basiert auf der Reduktion von Zink zu Zinkionen
(Zn(s)-->Zn2+(aq)+2e-)
und auf der Oxidation von Oxonium-Ionen zu Wasser
(2H3O+(aq) + 2e- -->H2(g)+2H2O(l))
Gesamtreaktion :
Zn(s)+2H3O+(aq)-->Zn2+(aq)+H2(g)+2H2O(l)
Hierbei wird eine Spannung von 0.7 Volt erreicht. (Quantitative Redoxreihe) Trotz der Benutzung einer Zink und Kupfer Elektrode findet hier eine andere Reaktion als im Daniell-Element statt. Dieses Wissen benutzte Alessandro Volta, als er im Jahre 1800 die erste Batterie erfand. Sein Aufbau bestand aus übereinandergeschichteten Kupfer, Zink und Elektrolyt-Schichten. Im Genauen : Auf eine Zinkplatte folgt ein mit Schwefelsäure getränkter Filz, worauf eine Kupferplatte folgt. Bis zu 20 dieser Elemente werden aufeinandergestapelt um die Spannung zu erhöhen. Da die Spannung während des Betriebes sinkt, und die Zink-Platten in der Schwefelsäure sehr schnell zersetzt werden, hat das Volta-Element nur noch historische Bedeutung.