Alkaline-Batterien: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: Bei der Alkaline Batterie, handelt es sich wie auch bei der Zink-Kohle Batterie um ein galvanisches Element mit einer Zink-Anode und einer Braunstein(Mangandioxid)-...) |
|||
| Zeile 1: | Zeile 1: | ||
Bei der Alkaline Batterie, handelt es sich wie auch bei der [[Zink-Kohle Batterie]] um ein galvanisches Element mit einer Zink-Anode und einer Braunstein(Mangandioxid)-Kathode.<br /> | Bei der Alkaline Batterie, handelt es sich wie auch bei der [[Zink-Kohle Batterie]] um ein galvanisches Element mit einer Zink-Anode und einer Braunstein(Mangandioxid)-Kathode.<br /> | ||
| − | Der wesentliche Unterschied zur Zink-Kohle Batterie liegt hier im Elektrolyten. Da in einer Alkaline-Batterie Kalilauge als Elektrolytlösung verwendet wird, findet ein Ladungsausgleich statt. Die oxidierten Zink-Ionen verbinden sich mit den Hydroxid-Ionen aus der Kalilauge, während bei der Reduktion des Mangandioxids neue Hydroxid-Ionen entstehen, welche in Lösung gehen und so die Konzentration des Elektrolyten halten.<br /><br />'''Reduktion:''' <math>MnO_{2} + H_{2}O + e^{-} \rightarrow MnO(OH) + OH^{-}</math><br />'''Oxidation:'''<math>Zn + 2OH^{-} \rightarrow Zn(OH)_{2} + 2e^{-}</math><br />Das hier entstehende Zinkhydroxid reagiert unter Abgabe von Wasser weiter zu Zinkoxid:<br /><math>Zn(OH)_{2} \rightarrow ZnO + H_{2}O</math><br />'''Redoxreaktion:'''<math>Zn + | + | Der wesentliche Unterschied zur Zink-Kohle Batterie liegt hier im Elektrolyten. Da in einer Alkaline-Batterie Kalilauge als Elektrolytlösung verwendet wird, findet ein Ladungsausgleich statt. Die oxidierten Zink-Ionen verbinden sich mit den Hydroxid-Ionen aus der Kalilauge, während bei der Reduktion des Mangandioxids neue Hydroxid-Ionen entstehen, welche in Lösung gehen und so die Konzentration des Elektrolyten halten.<br /><br />'''Reduktion:'''<br /> <math>MnO_{2} + H_{2}O + e^{-} \rightarrow MnO(OH) + OH^{-}</math><br /><br />'''Oxidation:'''<br /><math>Zn + 2OH^{-} \rightarrow Zn(OH)_{2} + 2e^{-}</math><br />Das hier entstehende Zinkhydroxid reagiert unter Abgabe von Wasser weiter zu Zinkoxid:<br /><math>Zn(OH)_{2} \rightarrow ZnO + H_{2}O</math><br /><br />'''Redoxreaktion:'''<br /><math>Zn + 2MnO_{2} + H_{2}O \rightarrow ZnO + 2MnO(OH)</math><br /><br />Da bei dieser Reaktion Wasser verbraucht wird sind leere Alkaline Batterien trocken<br />Aufgrund von höherer Kapazität und Belastbarkeit hat die Alkaline Batterie die Zink-Kohle Batterie im Laufe der Jahre vom Markt verdrängt. |
Version vom 30. Mai 2010, 21:56 Uhr
Bei der Alkaline Batterie, handelt es sich wie auch bei der Zink-Kohle Batterie um ein galvanisches Element mit einer Zink-Anode und einer Braunstein(Mangandioxid)-Kathode.
Der wesentliche Unterschied zur Zink-Kohle Batterie liegt hier im Elektrolyten. Da in einer Alkaline-Batterie Kalilauge als Elektrolytlösung verwendet wird, findet ein Ladungsausgleich statt. Die oxidierten Zink-Ionen verbinden sich mit den Hydroxid-Ionen aus der Kalilauge, während bei der Reduktion des Mangandioxids neue Hydroxid-Ionen entstehen, welche in Lösung gehen und so die Konzentration des Elektrolyten halten.
Reduktion:
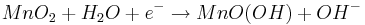
Oxidation: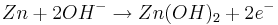
Das hier entstehende Zinkhydroxid reagiert unter Abgabe von Wasser weiter zu Zinkoxid: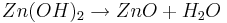
Redoxreaktion: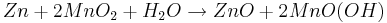
Da bei dieser Reaktion Wasser verbraucht wird sind leere Alkaline Batterien trocken
Aufgrund von höherer Kapazität und Belastbarkeit hat die Alkaline Batterie die Zink-Kohle Batterie im Laufe der Jahre vom Markt verdrängt.

