Nernst-Gleichung: Unterschied zwischen den Versionen
Aus KAS-Wiki
| Zeile 21: | Zeile 21: | ||
<math>F</math> Faraday-Konstante | <math>F</math> Faraday-Konstante | ||
| + | <br /> | ||
| + | <br /> | ||
| + | |||
| + | === '''Herleitung der Nernst-Gleichung''' === | ||
| + | ---- | ||
| + | <br /> | ||
| + | Am Beispiel einer [[Konzentrationszelle]] aus einer Standard-Silber-Halbzelle und einer Silberhalbzelle mit unterschiedlichen Konzentrationen lässt sich die Nernst-Gleichung in einfacher Form ableiten. | ||
Version vom 14. Dezember 2009, 10:39 Uhr
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren:
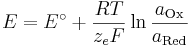
Unter Standardbedingungen vereinfacht sich die Nernst-Gleichung und man betrachtet nur noch die Abhängigkeit von der Konzentration.
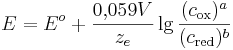
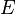 Elektrodenpotential
Elektrodenpotential
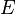 ° Standardelektronenpotential
° Standardelektronenpotential
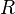 molare Gaskonstante
molare Gaskonstante
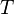 Temperatur in Kelvin
Temperatur in Kelvin
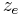 Anzahl der übertragenen Elektronen
Anzahl der übertragenen Elektronen
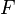 Faraday-Konstante
Faraday-Konstante
Herleitung der Nernst-Gleichung
Am Beispiel einer Konzentrationszelle aus einer Standard-Silber-Halbzelle und einer Silberhalbzelle mit unterschiedlichen Konzentrationen lässt sich die Nernst-Gleichung in einfacher Form ableiten.

