PH-Wert Abhängigkeit von Redoxsystemen
Das Elektrodenpotential von Redoxpaaren in sauren oder basischen Millieus hängt zusätzlich noch von dem pH-Wert des Redoxsystems ab.
Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential (siehe Quantitative Redoxreihe) kann man ebenfalls durch die Nernst-Gleichung aufzeigen.
Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu:
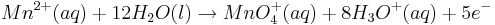
Steigt nun in diesem Beispiel die Konzentration der Oxonium-Ionen, so wird auch das Elektrodenpotential des Redoxpaares 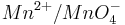 steigen.
steigen.
Denn formuliert man für dieses Redoxpaar die Nernst-Gleichung, so ergibt sich:
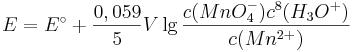
Setzt man nun voraus, dass die Konzentration der 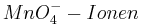 und die Konzentration der
und die Konzentration der 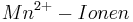 konstant bei
konstant bei 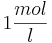 bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:
bleibt, so ergibt sich bei einem pH-Wert von 3 folgendes Eregebnis für das Elektrodenpotential:
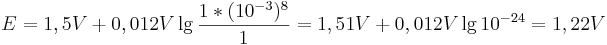
Vergleicht man diesen Wert mit einer Reaktion bei pH-Wert 1, so ergibt sich nach der Nernst-Gleich ein Potential von:
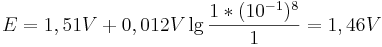
Man sieht nun, dass sich das Potential um 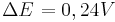 verändert hat.
verändert hat.
Denn das Argument des Logarithmus wurde kleiner und somit sinkt auch der Wert des Logarithmus, so dass auch das Elektrodenpotential des Redoxpaares kleiner werden muss.
Literaturverzeichnis
[1] Tausch, Michael: Chemie SII. Stoff - Formel - Umwelt. Aus: C.C.Buchner, Bamberg 2008, S. 191

