PKs und pKb-Wert
Bei dem pKs und dem pKb handelt es sich um Werte, die angeben wie stark eine Säure oder Base ist. Jede Säure hat einen charakteristischen pKs Wert, während jede Base einen charakteristischen pKb hat.
Diese Werte definieren sich jeweils über den negativen dekadischen Logarithmus der Ks- und Kb-Werte.
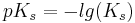
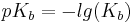
Addiert man die beiden Werte(pKs und pKb) eines Säure/konjugierte Base-Paars, ergeben diese immer eine Summe von 14.
Dies lässt sich mit den Gleichungen für den KTiefgestellt- und den Kb-Wert erklären, von denen pKb und pKs abhängen.
Ks(HA) = c(H30+)*c(A-)/c(HA)
Kb(A-) = c(OH-)*c(HA)/c(A-)
Multipliziert man diese beiden Gleichungen, kommt man nach Kürzung auf folgende Gleichung:
Ks(HA)*Kb(A-) = c(H3O+)*c(OH-)
Diese Gleichung entspricht wiederum der Wasserkonstanten Kw, welche bei Raumtemperatur immer 10^-14 Mol^2*l^-2 beträgt.
Dementsprechend:
Ks*Kb = 10^-14 Mol^2*l^-2
Durch die Anwendung des negativen dekadischen Logarithmus und der Definition des pKb- und pKs-Wertes kommt man somit auf die Gleichung:
pKs + pKb = 14
Da eine starke Säure einen hohen Ks-Wert hat, ist der pKs-Wert einer starken Säuren entsprechend gering und umgekehrt. Dies gilt analog für Kb und pKb.

