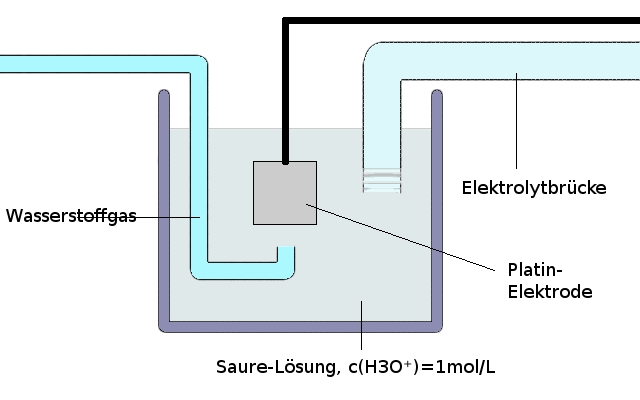
Standard-Wasserstoff-Halbzelle
Standard-Wasserstoff-Halbzelle
In der Elektrochemie sind galvanische Zellen eine wichtige Grundlage. Durch stattfindende Redoxreaktionen entstehenen Potentialdifferenzen zwischen den beteiligten Halbzellen. Da diese jedoch immer unterschiedlich groß sind, benötigen man einen Bezugspunkt, mit dem die verschiedenen Potentialdifferenzen in relation gebracht werden können. Hierfür wird eine so genannte Standard-Wasserstoff-Halbzelle verwendet.
In dieser Halbzelle spielt sich folgende Reaktion ab:
H2(g) + 2H2O(l) <-> 2H3O+(aq) + 2e-
Da es jedoch nicht möglich ist, eine Elektrode aus Wasserstoffgas zu bauen, benutzt man eine platinierte Platinelektrode, welche an der Reaktion nicht teilnimmt. In der rauen Oberfläche der Elektrode ist es nun möglich, dass sich Wasserstoffmoleküle ablagern und an der Redoxreaktion teilnehmen können.
Diese Wasserstoffhalbzelle wird mit dem Elektrodenpotential E0(H2/2H2O) = 0V gekennzeichnet. Wenn man nun eine galvanische Zelle aus einer Standart-Wasserstoffhalbzelle und einer beliebig anderen Halbzelle erstellt, so ist die entehende Spannung das Standard-Elektroden-Potential der Me/Mez+-Halbzelle.
Wenn eine Halbzelle den negativen Pol gegen die Wasserstoff-Halbzelle bildet, so besitzt diese eine negative Potentialdifferenz und anders herum.
Beispiel einer Wasserstoff-Halbzelle: