Elektrische Leitfähigkeit von wässrigen Lösungen
Definition
- Leitfähigkeit ist die Möglichkeit eines Stoffes, Strom zu leiten. Strom ist die Bewegung von elektrisch geladenen Teilchen wie Elektronen. Die Leitfähigkeit gibt also an, wie gut ein Stoff diesen geladenen Teilchen eine Bewegung ermöglicht.
- In wässrigen Lösungen gibt es Ionen als Ladungsträger. Diese sind gelöst und hydratisiert, sodass sie frei beweglich in der Lösung vorliegen.
- Metalle sind Elektronenleiter und Ionen-Lösungen Ionenleiter.
Hydratation oder Lösen von Salzen
Beim lösen von Salzen werden die Verbindungen zwischen den Ionen gelöst. Dies wird durch die dipolare Struktur des Wassers ermöglicht. Zwischen den Ionen und den Dipolen des Wassers kommt es zu elektrostatischen Wechselwirkungen. Positiv geladene Kationen werden von elektrisch negativen Seiten angezogen, negativ geladene Anionen von elektrisch positiven. Sobald das Ion stärker von den Dipolen angezogen wird, als von den anderen Ionen, löst sich jenes aus dem Gitter. Dann wird es sofort von den Wasser-Dipolen umgeben und diese bilden eine Hydrat-Hülle um das Molekül.
Dabei fällt auf, dass beim Lösen verschiedener Salze der Lösungsvorgang endo- oder exotherm ausfällt. Um dies zu erklären, stellt man die Lösungfortschritte einzeln energetisch dar.
Zunächst muss das Ionengitter des Salzes 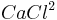 zerlegt werden. Die dafür benötigte Energie ist:
zerlegt werden. Die dafür benötigte Energie ist: 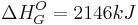
Da die Hydratationsenthalpie dieser Ionen 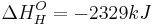 beträgt, ist eine Differenz von
beträgt, ist eine Differenz von 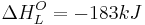 zu bemerken.
zu bemerken.
NOCH IN BEARBEITUNG

