Elektrolyse
Inhaltsverzeichnis[Verbergen] |
Vorgang der Elektrolyse
Die Elektrolyse ist eine unter Ionenentladung ablaufende Zerlegung einer chemischen Verbindung in seine Ausgangsstoffe durch den elektrischen Strom. Bei der Elektrolyse von Salzen zerlegt man das Salz in einer Salzlösung in seine zwei Ausgangsstoffe. Der Vorgang lässt sich auf die Ladungen der Ionen zurück führen. In einer Salzlösung müssen sich geladene Ionen befinden, da sie Strom leitet, was ein reiner Salzblock nicht tut.
Bei der Elektrolyse gibt man eine Salzlösung in ein U-Rohr an dessen Ende sich eine Kathode, der Minuspol und eine Anode, der Pluspol befinden. Wenn jetzt also elektrischer Strom durch die Salzlösung geleitet wird, beginnt die Ionenwanderung.
- Elektrolyse am Beispiel einer Kupferchloridlösung:
- Hier findet man ein passendes Bild zur Erklärung http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/redox/bilder/elektrolyse.gif
- Die positiv geladenen Kupferionen wandern zur Kathode, da dort Elektronenüberschuss besteht. Die negativ geladenen
- Chloridionen wandern zur Anode, da dort Elektronenmangel entsteht.
- An der Kathode enthalten die Kupferionen jeweils zwei Elektronen und werden so zum Kupferatom.
- Cu2+ + 2e- ->Cu
- An der Anode geben die ankommenden Cloridionen jeweils ein Elektron an die Anode ab, die entstehenden Cloratome vereinigen sich zu Chlormolekülen.
- 2Cl- -> 2Cl + 2e-
- 2CL -> CL2
An der Kathode werden so viele Elektronen abgegeben, wie an der Anode aufgenommen werden. Demnach muss die Gleichspannungsquelle der Kathode so viele Elektronen nachliefern, wie sie der Anode entzieht. Sie hat also die Aufgabe einer Elektronenpumpe.
Beispiele für Elektrolyse von Salzlösungen
Natriumgewinnung durch Elektrolyse
Die Metalle Natrium, Lithium, Kalium und Magnesium werden aus ihren Salzschmelzen elektrolytisch gewonnen. In einer "Downszelle" wird die Elektrolyse mit Natriumchlorid durchgeführt. Eine Downszelle ist eine Zelle mit einem gemauerten Kessel. Darin steht eine Graphitanode, umringt von einer Eisenkathode. Die beiden sind überdeckt mit einer Glocke aus Eisenblech. In den Kessel wird Calciumchlorid zugegeben, damit die Temperatur erniedrigt wird (600°C) Das Natrium fängt sich an der Kathode auf und die Chloridionen an der Anode. Das entstehende Chlorgas wird durch die Glocke abgeleitet.
Aluminiumgewinnung durch Elektrolyse
Aluminium kann durch Elektrolyse aus geschmolzenem Aluminiumoxid gewonnen werden. Reines Aluminiumoxid hat eine sehr hohe Schmelztemparatur (2050°C) deshalb löst man es in geschmolzenem Kryolith (Natrium-aluminium-fluorid). Die Schmelze wird in Wannen aus Kohle elektrolysiert. (Wannen dienen als Kathode). Als Anode werden die Kohleblöcke genutzt. An den Kohleblöcken entsteht Sauerstoff, das mit Kohlenstoff zu Kohlenstoffdioxid und Kohlenstoffmonooxid reagiert. Die Elektronen müssen dadurch erneuert werden. Dann hat man das flüssige Aluminium in der Wanne.
Der Entdecker Michael Faraday
Michael Faraday, der englische Physikochemiker, wurde am 22.September 1791 in Newington geboren und starb am 25.August 1867 in Hampton Court Green.
Mit 14 erlernte er die Lehre als Buchbinder. Während seiner siebenjährige Lehrzeit erwachte sein Interesse an Naturwissenschaften.
Er fertigte Notizen über seine Beobachtungen und Überlegungen an, von denen er einige Muster seiner Notizen Humphry Davy zeigte.
Dieser stellte ihn 1813 als Assistent in der Royal Institution in London ein.
Mit dieser Forschung wurde ihm:
- 1821 die Funktion eines Oberinspektors
- 1825 die eines Direktors
- 1827 die eines Professors der Chemie, die er bis 1867 bekleidete, übertragen.
Nebenbei war er auch Professor an der Militärschule in Woolwich. Er endeckte die Elektrolyse und fürhte in diesem Zusammenhang die Begriffe: Ion, Anion, Kation, Anode, Kathode, Elektrode und Elektrolyse ein
Praktisches Beispiel einer Kaliumiodid-Elektrolyse
Versuchsprotokoll
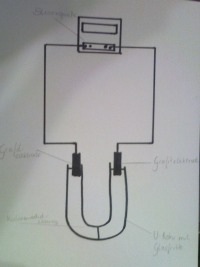
Material: Chemikalien: Kaliumiodid-Lsg U-Rohr mit Glasfritte; 2 Graphitelektroden, Stromquelle, Verbindungsschnüre mit Krokodielklemmme, Stativmaterial, Unterlage (unter einem Abzug durchzuführen)
Durchführung
Man befüllt beide Schenkel des U-Rohres mit der Kaliumiodid-Lösung und einem Indikator.
Dabei erfolgt die Anordnung der Elektroden und der Meßinstrumente, wie
auf der Schaltskizze dargestellt.
Nun wir der Gleichstrom angestellt,
wobei etwa eine Spannung von 4V angelegt sein sollte.
Dann wartet man einige Minuten.
Beobachtung Nach einiger Zeit des wartens, wo der Strom angestellt ist und die Elektrolyse im vollen Gange ist kann man dank des Indikators eine deutlich farbliche Veränderung sehen. An der Anode wird es Rot und an der Katode blau.
Anode: 2I- -> I- + 2e- (Oxidation)
I- + H+ -> HI
Katode: 2K+ + 2e -> 2K 2K+ + 2OH- -> 2KOH
Die An der Anode versammelte Iodidsäure (HI) zeigt sich rot und die um die Katode versammelte Kalilauge (KOH) zeigt sich blau.
Filmmaterial zum Kaliumiodid-Elektrolysen Versuch
Quellenangaben
- http://www.wikipedia.org/
- Elemente Chemie NRW 09/10, Klett Verlag