Nernst-Gleichung
Aus KAS-Wiki
Version vom 14. Dezember 2009, 09:32 Uhr von Felix C. (Diskussion | Beiträge)
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren:
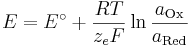
Unter Standardbedingungen vereinfacht sich die Nernst-Gleichung und man betrachtet nur noch die Abhängigkeit von der Konzentration.
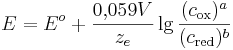
wobei
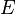 Elektrodenpotential
Elektrodenpotential
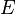 ° Standardelektronenpotential
° Standardelektronenpotential
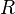 Universelle Gaskonstante|Universelle oder molare Gaskonstante, R = 8,31447 J mol−1 K−1
Universelle Gaskonstante|Universelle oder molare Gaskonstante, R = 8,31447 J mol−1 K−1
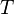 absolute Temperatur(=Temperatur in Kelvin)
absolute Temperatur(=Temperatur in Kelvin)
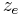 Anzahl der übertragenen Elektronen
Anzahl der übertragenen Elektronen
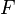 Faraday-Konstante
Faraday-Konstante

