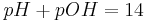Autoprotolyse des Wassers, Ionenprodukt des Wasser und pH-Wert: Unterschied zwischen den Versionen
| Zeile 5: | Zeile 5: | ||
Im Wasser herrscht also folgendes chemisches Gleichgewicht:<br /> | Im Wasser herrscht also folgendes chemisches Gleichgewicht:<br /> | ||
H<sub>2</sub>O + H<sub>2</sub>O <=> H<sub>3</sub>O<sup>+</sup> + OH<sup>-</sup><br /> | H<sub>2</sub>O + H<sub>2</sub>O <=> H<sub>3</sub>O<sup>+</sup> + OH<sup>-</sup><br /> | ||
| − | Wenn man nun das | + | Wenn man nun das Massenwirkungsgesetz auf diese Reaktion anwendet, so erhält man:<br /> |
<math>K=\frac {c(H_{3}O^{+})*c(OH^{-})}{c^2(H_2O)}</math><br /> | <math>K=\frac {c(H_{3}O^{+})*c(OH^{-})}{c^2(H_2O)}</math><br /> | ||
Wobei Leitfähigkeitsmessungen ergaben: K<sub>w</sub>=3,258x10<sup>-18</sup>. | Wobei Leitfähigkeitsmessungen ergaben: K<sub>w</sub>=3,258x10<sup>-18</sup>. | ||
Aktuelle Version vom 14. April 2010, 22:22 Uhr
Autoprotolyse des Wassers
Selbst reinstes destilliertes Wasser hat noch eine geringe elektrische Leitfähigkeit. Dies haben äußerst genaue Messungen ergeben.
Daher liegt der Schluss nahe, dass im Wasser Ionen enthalten sind. Diese Ionen sind Oxonium-Ionen (H3O+) und Hydroxid-Ionen (OH-).
Im Wasser herrscht also folgendes chemisches Gleichgewicht:
H2O + H2O <=> H3O+ + OH-
Wenn man nun das Massenwirkungsgesetz auf diese Reaktion anwendet, so erhält man:
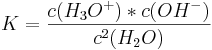
Wobei Leitfähigkeitsmessungen ergaben: Kw=3,258x10-18.
An dem sehr kleinen Zahlenwert lässt sich erkennen, dass das Gleichgewicht sehr stark auf der Edukt-Seite der Reaktion liegt, d.h. die Rückreaktion (Neutralisationsreaktion) findet vermehrt statt. Die Konzentration des Wassers ist Konstant und liegt bei 55.398 mol/l. Man multipliziert die Konzentration des Wassers zum Quadrat in die Gleichgewichtskonstante und erhält eine neue Konstante Kw
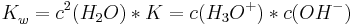
Durch einsetzen der konkreten Zahlen für K und die Konzentration des Wassers erhält man:
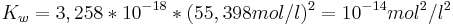
Durch Anwendung der Logarithmus-Gesetze und die Definition des pH-Wertes/pOH-Wertes ergibt sich: