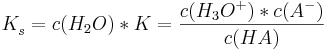Autoprotolyse des Wassers, Ionenprodukt des Wasser und pH-Wert
Aus KAS-Wiki
Version vom 14. April 2010, 21:57 Uhr von Fabian He. (Diskussion | Beiträge)
Autoprotolyse des Wassers
Selbst reintest destilliertes Wasser hat noch eine geringe elektrische Leitfähigkeit. Dies haben äußerst genaue Messungen ergeben.
Daher liegt der Schluss nahe, dass im Wasser Ionen enthalten sind. Diese Ionen sind Oxonium-Ionen (H3O+) und Hydroxid-Ionen (OH-).
Im Wasser herrscht also folgendes chemisches Gleichgewicht:
H2O + H2O <=> H3O+ + OH-
Wenn mann nun das Massenwirkunsgesetz auf diese Reaktion anwendet, so erhält man:
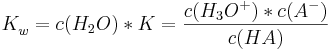
Wobei Leitfähigkeitsmessungen ergaben: Kw=