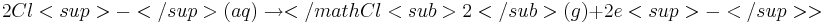Chlor-Alkali Elektrolyse: Unterschied zwischen den Versionen
(→Chloralkali-Elektrolyse) |
(→Reaktion an der Anode) |
||
| Zeile 18: | Zeile 18: | ||
An der Anode geben die Chloridionen ihre Ladung ab. Es entsteht dabei elementares Chlor. | An der Anode geben die Chloridionen ihre Ladung ab. Es entsteht dabei elementares Chlor. | ||
| − | 2Cl<sup>-</sup>(aq) <math>\rightarrow</math> | + | 2Cl<sup>-</sup>(aq) <math>2Cl<sup>-</sup>(aq) \rightarrow</math Cl<sub>2</sub>(g)+2e<sup>-</sup>> |
Version vom 15. Dezember 2009, 13:58 Uhr
Chloralkali-Elektrolyse
Mit der Chloralkali-Elektrolyse werden die wichtigen Grundchemikalien Chlor, Wasserstoff und Natronlauge aus Natriumchlorid erzeugt.
Dafür wird Steinsalz, das neben wenigen anderen Salzen vor allem aus Natriumchlorid (Kochsalz) besteht, in Wasser gelöst und elektrolysiert.
Die Chloralkali-Elektrolyse ist eine endotherme Reaktion. Die benötigte Energie von 454 kJ/mol wird in Form von elektrischem Strom zugeführt.
Reaktionsablauf
Wenn man Kochsalz in Wasser löst, zerfällt es in positiv geladene Natriumionen (Na+) und negativ geladene Chloridionen (Cl-). Darüber hinaus befinden sich in einer solchen Lösung, ebenso wie in jeder wässrigen Lösung, positiv geladene Wasserstoffionen (H+), sogenannte Protonen und negativ geladene Hydroxidionen (OH-).
Wird nun Strom durch eine solche Lösung geleitet, wandern die negativ geladenen Ionen zur positiven Elektrode, der Anode und die positiv geladenen Ionen zur negativ geladenen Elektrode, der Kathode.
Reaktion an der Anode
An der Anode geben die Chloridionen ihre Ladung ab. Es entsteht dabei elementares Chlor.
2Cl-(aq)