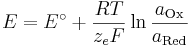Nernst-Gleichung: Unterschied zwischen den Versionen
Aus KAS-Wiki
| Zeile 1: | Zeile 1: | ||
| − | Die ''Nernst-Gleichung'' beschreibt den Einfluss der Konzentration | + | Die '''Nernst-Gleichung''' beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems. <br /> |
| − | + | Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren: <br /> | |
| − | + | ||
| − | + | ||
<br /> | <br /> | ||
<math>E = E^\circ + \frac{RT}{z_e F}\ln\frac{a_\mathrm{Ox}}{a_\mathrm{Red}}</math> <br /> | <math>E = E^\circ + \frac{RT}{z_e F}\ln\frac{a_\mathrm{Ox}}{a_\mathrm{Red}}</math> <br /> | ||
Version vom 14. Dezember 2009, 10:24 Uhr
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren: