Nernst-Gleichung: Unterschied zwischen den Versionen
Aus KAS-Wiki
| Zeile 8: | Zeile 8: | ||
<math>E = E^{o}+\frac{0{,}059 V}{z_e}\lg\frac{(c_\mathrm{ox})^a}{(c_\mathrm{red})^b}</math> <br /> | <math>E = E^{o}+\frac{0{,}059 V}{z_e}\lg\frac{(c_\mathrm{ox})^a}{(c_\mathrm{red})^b}</math> <br /> | ||
| − | + | <br /> | |
<math>E</math> Elektrodenpotential | <math>E</math> Elektrodenpotential | ||
| Zeile 14: | Zeile 14: | ||
<math>E</math>° Standardelektronenpotential | <math>E</math>° Standardelektronenpotential | ||
| − | <math>R</math> | + | <math>R</math> molare Gaskonstante |
| − | <math>T</math> | + | <math>T</math> Temperatur in Kelvin |
<math>z_e</math> Anzahl der übertragenen Elektronen | <math>z_e</math> Anzahl der übertragenen Elektronen | ||
<math>F</math> Faraday-Konstante | <math>F</math> Faraday-Konstante | ||
Version vom 14. Dezember 2009, 10:34 Uhr
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren:
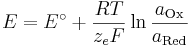
Unter Standardbedingungen vereinfacht sich die Nernst-Gleichung und man betrachtet nur noch die Abhängigkeit von der Konzentration.
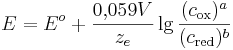
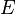 Elektrodenpotential
Elektrodenpotential
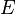 ° Standardelektronenpotential
° Standardelektronenpotential
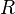 molare Gaskonstante
molare Gaskonstante
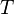 Temperatur in Kelvin
Temperatur in Kelvin
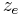 Anzahl der übertragenen Elektronen
Anzahl der übertragenen Elektronen
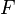 Faraday-Konstante
Faraday-Konstante

