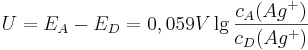Nernst-Gleichung: Unterschied zwischen den Versionen
(→Herleitung der Nernst-Gleichung) |
(→Herleitung der Nernst-Gleichung) |
||
| Zeile 31: | Zeile 31: | ||
<br /> | <br /> | ||
<br /> | <br /> | ||
| − | <math> U = 0,059 V\lg\frac{c_{A}(Ag^{+})}{c_{D}(Ag^{+})} </math> | + | <math> U = 0,059 V\lg\frac{c_{A}(Ag^{+})}{c_{D}(Ag^{+})} </math> |
<br /> | <br /> | ||
<br /> | <br /> | ||
wobei <math>c_A</math> die Konzentration in der Donator-Halbzelle angibt und <math>c_D</math> die Konzentration in der Donator-Halbzelle. | wobei <math>c_A</math> die Konzentration in der Donator-Halbzelle angibt und <math>c_D</math> die Konzentration in der Donator-Halbzelle. | ||
| + | Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass wir die Spannung der Halbzelle in Bezug auf die Standardzelle gemessen haben. Die Zellspannung ergibt sich dabei aus der Differenz der Elektroden-Potentiale der einzelnen Halbzellen und somit gilt: | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <math> U = E_{A} - E_{D} = 0,059 V\lg\frac{c_{A}(Ag^{+})}{c_{D}(Ag^{+})} </math> | ||
Version vom 14. Dezember 2009, 18:05 Uhr
Die Nernst-Gleichung beschreibt den Einfluss der Konzentration auf das Potential eines Redoxsystems.
Allgemein lässt sich die Nernst-Gleichung wie folgt formulieren:
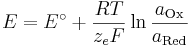
Unter Standardbedingungen vereinfacht sich die Nernst-Gleichung und man betrachtet nur noch die Abhängigkeit von der Konzentration.
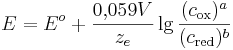
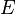 Elektrodenpotential
Elektrodenpotential
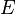 ° Standardelektronenpotential
° Standardelektronenpotential
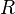 molare Gaskonstante
molare Gaskonstante
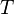 Temperatur in Kelvin
Temperatur in Kelvin
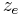 Anzahl der übertragenen Elektronen
Anzahl der übertragenen Elektronen
 Faraday-Konstante
Faraday-Konstante
Herleitung der Nernst-Gleichung
Am Beispiel einer Konzentrationszelle aus einer Standard-Silber-Halbzelle und einer Silberhalbzelle mit unterschiedlichen Konzentrationen lässt sich die Nernst-Gleichung in einfacher Form ableiten.
Variiert man nämlich die Konzentration der Nicht-Standard-Silberzelle und misst die resultierende Spannung, kann man die Messreihe mit Hilfe der Logarithmus-Funktion linearisieren:
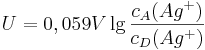
wobei 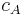 die Konzentration in der Donator-Halbzelle angibt und
die Konzentration in der Donator-Halbzelle angibt und 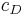 die Konzentration in der Donator-Halbzelle.
Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass wir die Spannung der Halbzelle in Bezug auf die Standardzelle gemessen haben. Die Zellspannung ergibt sich dabei aus der Differenz der Elektroden-Potentiale der einzelnen Halbzellen und somit gilt:
die Konzentration in der Donator-Halbzelle.
Unser Ziel ist es aber, die Spannung in einer einzelnen Zelle bestimmen zu können. Dazu macht man sich am besten klar, dass wir die Spannung der Halbzelle in Bezug auf die Standardzelle gemessen haben. Die Zellspannung ergibt sich dabei aus der Differenz der Elektroden-Potentiale der einzelnen Halbzellen und somit gilt: