Oxidationszahl: Unterschied zwischen den Versionen
| Zeile 21: | Zeile 21: | ||
3. In Molekülen ordnet man die Bindungselektronen des weniger elektronegativeren Atoms dem elektronegativerem Atom zu.<br /> | 3. In Molekülen ordnet man die Bindungselektronen des weniger elektronegativeren Atoms dem elektronegativerem Atom zu.<br /> | ||
Beispiel H-Cl (kommt)<br /> | Beispiel H-Cl (kommt)<br /> | ||
| − | 4. Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0, die eines mehratomigen Ions hingegen die Gesamtladung des Ions. | + | 4. Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0, die eines mehratomigen Ions hingegen die Gesamtladung des Ions.<br /> |
Version vom 15. Dezember 2009, 14:01 Uhr
Die Oxidationszahl (auch Oxidationsstufe, Oxidationswert, elektrochemische Wertigkeit) gibt die aufgenommenen oder abgegebenen Elementarladungen einzelner Atome oder Moleküle an und hilft beim Aufstellen von Reaktionsgleichungen.
Dazu wird zuerst die Oxidationszahl der einzelnen Atome aufgestellt und als römische Zahl über dem Atom notiert. Hierbei werdem dem jeweils Elektronegativerem Atom eines Moleküls die Bindungselektronen der an der Bindung beteiligten Atome zugeschrieben. Hat das Atom einen Elektronenüberschuss wird dazu eine negative Zahl notiert (Beispiel Sauerstoff-Ion: O2- (Sauerstoff ist in der Regel zweifach positiv geladen) (Kommt noch)), hat es einen Elektronenmangel wird eine positive Zahl notiert (Metalle haben in der Regel positive Oxidationszahlen, Beispiel Magnesium-Ion: Mg2+ (kommt auch noch))
Anschließend werden die Teilgleichungen als Molekül zusammengefasst und addieren sich dabei (Beispiel MgO (kommt)....
Angabe der Oxidationszahl
DIe Oxidationszahl wird über dem Atom als römische Ziffer notiert.
Beispiel Magnesiumoxid: 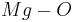 (Oxidationszahlen darüber kommen noch)
(Oxidationszahlen darüber kommen noch)
Bestimmung der Oxidationszahl
Hauptregeln:
1. Atome im molekularem Zustand haben immer die Oxidationszahl 0.
Beispiel : H-H (kommt)
2. Die Oxidationszahl einzelner Ionen ist gleich ihrer Ladungszahl.
Beispiel Mg2+ (kommt)
3. In Molekülen ordnet man die Bindungselektronen des weniger elektronegativeren Atoms dem elektronegativerem Atom zu.
Beispiel H-Cl (kommt)
4. Die Summe der Oxidationszahlen aller Atome einer mehratomigen neutralen Verbindung ist gleich 0, die eines mehratomigen Ions hingegen die Gesamtladung des Ions.

