PH-Wert Abhängigkeit von Redoxsystemen: Unterschied zwischen den Versionen
Aus KAS-Wiki
(Die Seite wurde neu angelegt: Das Elektrodenpotential von Redoxpaaren in sauren oder basischen Millieus hängt zusätzlich noch von dem pH-Wert des Redoxsystems ab. Diese Beziehung zwischen dem pH-W...) |
|||
| Zeile 2: | Zeile 2: | ||
Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential kann man ebenfalls durch die [[Nernst-Gleichung]] aufzeigen. | Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential kann man ebenfalls durch die [[Nernst-Gleichung]] aufzeigen. | ||
Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu: | Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu: | ||
| − | + | <br /> | |
| + | <br /> | ||
<math> Mn^{2+}(aq) + 12 H_{2}O(l) \rightarrow MnO^{+}_{4}(aq) + 8H_{3}O^{+}(aq) + 5e^{-}</math> | <math> Mn^{2+}(aq) + 12 H_{2}O(l) \rightarrow MnO^{+}_{4}(aq) + 8H_{3}O^{+}(aq) + 5e^{-}</math> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | Steigt nun in diesem Beispiel die Konzentration der Oxonium-Ionen, so wird auch das Elektrodenpotential des Redoxpaares <math>Mn^{2+} / MnO^{-}_{4}</math> steigen. | ||
Version vom 15. Dezember 2009, 14:00 Uhr
Das Elektrodenpotential von Redoxpaaren in sauren oder basischen Millieus hängt zusätzlich noch von dem pH-Wert des Redoxsystems ab.
Diese Beziehung zwischen dem pH-Wert und dem Elektrodenpotential kann man ebenfalls durch die Nernst-Gleichung aufzeigen.
Dazu betrachtet man beispielhaft die folgende Reaktion in saurem Millieu:
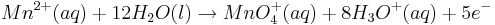
Steigt nun in diesem Beispiel die Konzentration der Oxonium-Ionen, so wird auch das Elektrodenpotential des Redoxpaares 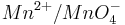 steigen.
steigen.

