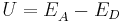Potentiometrische Konzentrationsbestimmung
Man kann dieses Verfahren nutzen, um die ,oft sehr kleine, Konzentration von Metall-Ionen in einer Lösung zu ermitteln.
Denn wenn man ein Metall in die Lösung seines Salzes eintaucht so stellt sich ein elektrochemisches Gleichgewicht ein:
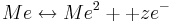
Das heißt, dass ein Metall Me in Lösung geht und dabei z Elektronen freigibt. Gleichzeitig nimmt das Metall-Ion in der Lösung z Elektronen auf und wird fest.
Dabei entsteht ein Elektrodenpotenzial E. Dieses kann man rechnerisch und experimentell bestimmen.
Die Nernst-Gleichung zeigt die Abhängigkeit des Elektrodenpotentials von der Konzentration der Stoffe,
die an der Elektronenübertragungsreaktion beteiligt sind.
Das Elektrodenpotential einer Metallhalbzelle kann man mit folgender Formel berechnen.
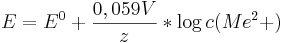
Nun kann man in einem galvanischen Element aus zwei Metallhalbzellen gleicher Metalle die Konzentration der einen Lösung errechnen.
Dazu benötigt man die höhere und bekannte Konzentration der Lösung einer Halbzelle und die Gesamtspannung U der Galvanischen Zelle, auch Potentialdifferenz genannt.
Die beiden Halbzellen sind über eine Salzbrücke verbunden.
Die Oxidation findet am Minuspol (Anode) statt. Diese ist die Metallhalbzelle mit der kleineren Ionen-Konzentration. Sie ist also der Donator 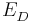 .
.
Die Metallhalbzelle mit der größeren Ionen-Konzentration bildet den Pluspol (Kathode) der galvanischen Zelle. Hier findet die Reduktion statt.
Also ist die Kathode der Akzeptor und wird mit 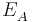 bezeichnet. Die Spannung U der galvanischen Zelle berechnet sich wie folgt:
bezeichnet. Die Spannung U der galvanischen Zelle berechnet sich wie folgt: