Protolysegrad: Unterschied zwischen den Versionen
Aus KAS-Wiki
(Die Seite wurde neu angelegt: Der Protolysegrad oder auch Dissoziationsgrad wird als <math>\alpha</math> angegeben und gibt das Protolyse-Gleichgewicht einer Säure an. Er wird so definiert: <math>...) |
|||
| Zeile 1: | Zeile 1: | ||
| − | Der Protolysegrad oder auch Dissoziationsgrad wird als <math>\alpha</math> angegeben und gibt das Protolyse-Gleichgewicht einer Säure an. | + | Der Protolysegrad oder auch Dissoziationsgrad wird als <math>\alpha</math> angegeben und gibt das Protolyse-Gleichgewicht einer Säure an.<br /> |
| − | + | Er wird so definiert: <math>\alpha = \frac{Anzahl\; der\; protolysierten\; S\ddot{a}ure-Teilchen}{Anzahl\; der\; gesamten\; S\ddot{a}ure-Teilchen}</math><br /> | |
| − | Er wird so definiert: <math>\alpha = \frac{Anzahl\; der\; protolysierten\; S\ddot{a}ure-Teilchen}{Anzahl\; der\; gesamten\; S\ddot{a}ure-Teilchen}</math> | + | Also gilt: <math>\alpha = \frac{c(H _3O ^+)}{c _0(HA)}</math><br /> |
| − | + | <br /> | |
| − | Also gilt: <math>\alpha = \frac{c(H _3O ^+)}{c _0(HA)}</math> | + | Mithilfe des Massenwirkungsgesetzes kann nun die folgende Beziehung zwischen dem Protolysegrad <math>\alpha</math> und der Säurekonstanten K<sub>s</sub> einer Säure HA aufgestellt werden:<br /> |
| − | + | <math>HA + H _2 O \leftrightarrow H _3 O ^+ + A ^-</math><br /> | |
| − | Mithilfe des Massenwirkungsgesetzes kann nun die folgende Beziehung zwischen dem Protolysegrad <math>\alpha</math> und der Säurekonstanten K<sub>s</sub> einer Säure HA aufgestellt werden: | + | Wenn dabei HA vor der Reaktion die Konzentration c<sub>0</sub> hat, haben sowohl H<sub>3</sub>O<sup>+</sup> als auch A<sup>-</sup> die Konzentration 0.<br /> |
| + | Wenn sich nun das Gleichgewicht eingestellt hat, hat HA die Konzentration <math>c _0 - \alpha\cdot c _0</math> und H<sub>3</sub>O<sup>+</sup> und A<sup>-</sup> haben somit die Konzentration <math>\alpha\cdot c _0</math><br /> | ||
| + | Somit kann man das Ostwaldsche Verdünnungsgesetz <math>K _s = \frac{\alpha \cdot c _0 \cdot \alpha \cdot c _0}{c _0 - \alpha \cdot c _0}=\frac{\alpha ^2 \cdot c _0}{1- \alpha}</math> aufstellen, in welchem nochmals deutlich wird, dass der Protolysegrad von der Anfangskonzentration c<sub>0</sub> der Säure ist. | ||
Version vom 14. April 2010, 22:36 Uhr
Der Protolysegrad oder auch Dissoziationsgrad wird als 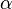 angegeben und gibt das Protolyse-Gleichgewicht einer Säure an.
angegeben und gibt das Protolyse-Gleichgewicht einer Säure an.
Er wird so definiert: 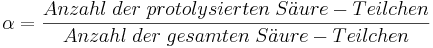
Also gilt: 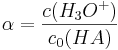
Mithilfe des Massenwirkungsgesetzes kann nun die folgende Beziehung zwischen dem Protolysegrad 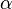 und der Säurekonstanten Ks einer Säure HA aufgestellt werden:
und der Säurekonstanten Ks einer Säure HA aufgestellt werden:
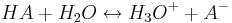
Wenn dabei HA vor der Reaktion die Konzentration c0 hat, haben sowohl H3O+ als auch A- die Konzentration 0.
Wenn sich nun das Gleichgewicht eingestellt hat, hat HA die Konzentration 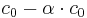 und H3O+ und A- haben somit die Konzentration
und H3O+ und A- haben somit die Konzentration 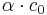
Somit kann man das Ostwaldsche Verdünnungsgesetz 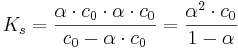 aufstellen, in welchem nochmals deutlich wird, dass der Protolysegrad von der Anfangskonzentration c0 der Säure ist.
aufstellen, in welchem nochmals deutlich wird, dass der Protolysegrad von der Anfangskonzentration c0 der Säure ist.

