Redox-Titration: Unterschied zwischen den Versionen
Max G. (Diskussion | Beiträge) (Die Seite wurde neu angelegt: Im Prinzip verläuft die Redoxtitration genauso wie die bisher bekannte Säure-Base-Titration. Durch titrieren zu einem Stoff bekannter Konzentration möchte man die Ko...) |
Max G. (Diskussion | Beiträge) |
||
| Zeile 2: | Zeile 2: | ||
Hierbei unterscheidet sich nun die Redoxtitration von den anderen Titrationen. Es wird nämlich die Probe(Stoff unbekannter Konzentration) zu der Maßlösung Titriert, bisher war es andersrum. | Hierbei unterscheidet sich nun die Redoxtitration von den anderen Titrationen. Es wird nämlich die Probe(Stoff unbekannter Konzentration) zu der Maßlösung Titriert, bisher war es andersrum. | ||
Desweiteren muss man beachten, dass bei dieser Art von Titration keine Protolyse stattfindet, sondern, wie der Name schon sagt, eine Redoxreaktion. Diese laufen meistens nur im sauren bzw. basischen Milieu ab. | Desweiteren muss man beachten, dass bei dieser Art von Titration keine Protolyse stattfindet, sondern, wie der Name schon sagt, eine Redoxreaktion. Diese laufen meistens nur im sauren bzw. basischen Milieu ab. | ||
| − | Ziel der Redoxtitration ist es einen Farbumschlag in der | + | Beispiel: Titration von Kaliumpermanganat in Oxalat |
| + | 2MnO<math><index> 4 </index></math> | ||
| + | Ziel der Redoxtitration ist es einen Farbumschlag in der Maßlösung zu erreichen. Zu diesem Zeitpunkt hat die Stoffmenge der Probe die der Maßlösung erreicht bzw. schon fast überschritten. Dieser Zeitunkt wird Äquivavelnzpunkt genannt. | ||
Version vom 19. Mai 2010, 20:41 Uhr
Im Prinzip verläuft die Redoxtitration genauso wie die bisher bekannte Säure-Base-Titration. Durch titrieren zu einem Stoff bekannter Konzentration möchte man die Konzentration bzw. Stoffmenge eines Stoffes von unbekannter Konzentration herausfinden.
Hierbei unterscheidet sich nun die Redoxtitration von den anderen Titrationen. Es wird nämlich die Probe(Stoff unbekannter Konzentration) zu der Maßlösung Titriert, bisher war es andersrum.
Desweiteren muss man beachten, dass bei dieser Art von Titration keine Protolyse stattfindet, sondern, wie der Name schon sagt, eine Redoxreaktion. Diese laufen meistens nur im sauren bzw. basischen Milieu ab.
Beispiel: Titration von Kaliumpermanganat in Oxalat
2MnO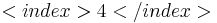 Ziel der Redoxtitration ist es einen Farbumschlag in der Maßlösung zu erreichen. Zu diesem Zeitpunkt hat die Stoffmenge der Probe die der Maßlösung erreicht bzw. schon fast überschritten. Dieser Zeitunkt wird Äquivavelnzpunkt genannt.
Ziel der Redoxtitration ist es einen Farbumschlag in der Maßlösung zu erreichen. Zu diesem Zeitpunkt hat die Stoffmenge der Probe die der Maßlösung erreicht bzw. schon fast überschritten. Dieser Zeitunkt wird Äquivavelnzpunkt genannt.

