Redoxreihe der Metalle: Unterschied zwischen den Versionen
(Kategorie; Zeilenumbrüche) |
|||
| Zeile 1: | Zeile 1: | ||
| − | Wie edel oder unedel ein Metall ist, hängt von seiner Tendenz, in Redoxreaktionen Elektronen abzugeben, ab. | + | Wie edel oder unedel ein Metall ist, hängt von seiner Tendenz, in Redoxreaktionen Elektronen abzugeben, ab. |
| − | Je nach Reaktionspartner kann ein Metall-Ion sowohl ein Reduktionsmittel sein, das oxidiert wird, als auch ein Oxidationsmittel, das reduziert wird. ([[Donator-Akzeptor-Reaktionen]]) | + | |
| − | Das System aus Reduktor und dem zugehörigen Oxidator wird als '''korrespondierendes Redoxpaar''' bezeichnet. | + | Je nach Reaktionspartner kann ein Metall-Ion sowohl ein Reduktionsmittel sein, das oxidiert wird, als auch ein Oxidationsmittel, das reduziert wird. ([[Donator-Akzeptor-Reaktionen]]) |
| + | |||
| + | Das System aus Reduktor und dem zugehörigen Oxidator wird als '''korrespondierendes Redoxpaar''' bezeichnet. | ||
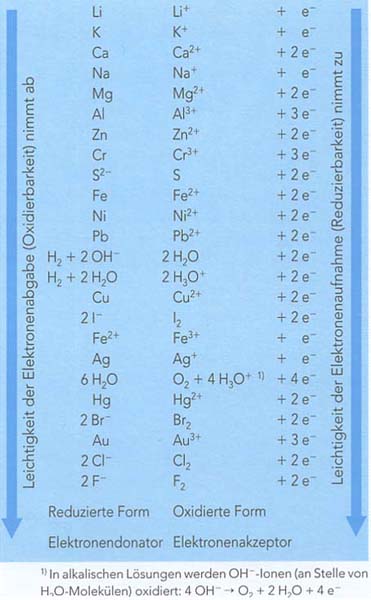
Ordnet man nun alle korrespondierenden Redoxpaare entweder nach dem Reduktionsvermögen der Metall-Atome oder dem Oxidationsvermögen der Metall-Ionen, erhält man diese Reihenfolge: | Ordnet man nun alle korrespondierenden Redoxpaare entweder nach dem Reduktionsvermögen der Metall-Atome oder dem Oxidationsvermögen der Metall-Ionen, erhält man diese Reihenfolge: | ||
| Zeile 13: | Zeile 15: | ||
---- | ---- | ||
| − | Am oberen Ende der Redoxreihe sind Metalle zu finden, welche die stärksten Elektronen-Donatoren sind. | + | Am oberen Ende der Redoxreihe sind Metalle zu finden, welche die stärksten Elektronen-Donatoren sind. |
| − | + | ||
| − | + | Analog dazu finden sich am unteren Ende der Reihe die Edelmetalle, welche die stärksten Elektronen-Akzeptoren sind. | |
| − | + | ||
| − | + | ||
| + | Das Redoxpaar Wasserstoff/Oxonium-Ionen nimmt eine besondere Stellung innerhalb der Redoxreihe ein. | ||
| + | |||
| + | Es bildet die Trennlinie zwischen den sogenannten "unedlen" bzw "edlen" Metallen. | ||
| + | |||
| + | Metalle, deren Atome von Oxonium-Ionen oxidiert werden, bezeichnet man als unedel; Metalle, die nicht von Oxonium-Ionen oxidiert werden, bezeichnet man als edel. | ||
| + | |||
| + | |||
| + | == Siehe auch == | ||
| − | |||
| − | |||
[[Quantitative Redoxreihe]] | [[Quantitative Redoxreihe]] | ||
| − | + | == Literaturverzeichnis == | |
| + | |||
| − | |||
[1] Tausch, Michael: ''Chemie SII. Stoff - Formel - Umwelt'', Aus: C.C.Buchner, Bamberg 2008, S. 169-171 | [1] Tausch, Michael: ''Chemie SII. Stoff - Formel - Umwelt'', Aus: C.C.Buchner, Bamberg 2008, S. 169-171 | ||
| + | |||
| + | |||
| + | [[Kategorie:Elektrochemie]] | ||
Version vom 4. August 2010, 17:18 Uhr
Wie edel oder unedel ein Metall ist, hängt von seiner Tendenz, in Redoxreaktionen Elektronen abzugeben, ab.
Je nach Reaktionspartner kann ein Metall-Ion sowohl ein Reduktionsmittel sein, das oxidiert wird, als auch ein Oxidationsmittel, das reduziert wird. (Donator-Akzeptor-Reaktionen)
Das System aus Reduktor und dem zugehörigen Oxidator wird als korrespondierendes Redoxpaar bezeichnet.
Ordnet man nun alle korrespondierenden Redoxpaare entweder nach dem Reduktionsvermögen der Metall-Atome oder dem Oxidationsvermögen der Metall-Ionen, erhält man diese Reihenfolge:
Anmerkung: Diese Tabelle listet sowohl Metalle als auch Nichtmetalle auf !
Am oberen Ende der Redoxreihe sind Metalle zu finden, welche die stärksten Elektronen-Donatoren sind.
Analog dazu finden sich am unteren Ende der Reihe die Edelmetalle, welche die stärksten Elektronen-Akzeptoren sind.
Das Redoxpaar Wasserstoff/Oxonium-Ionen nimmt eine besondere Stellung innerhalb der Redoxreihe ein.
Es bildet die Trennlinie zwischen den sogenannten "unedlen" bzw "edlen" Metallen.
Metalle, deren Atome von Oxonium-Ionen oxidiert werden, bezeichnet man als unedel; Metalle, die nicht von Oxonium-Ionen oxidiert werden, bezeichnet man als edel.
Siehe auch
Literaturverzeichnis
[1] Tausch, Michael: Chemie SII. Stoff - Formel - Umwelt, Aus: C.C.Buchner, Bamberg 2008, S. 169-171