Ur-Batterie/Bagdad-Batterie: Unterschied zwischen den Versionen
| Zeile 10: | Zeile 10: | ||
<u>Reaktionen:</u> | <u>Reaktionen:</u> | ||
| − | An der Eisenanode oxidieren Eisenatome zu Eisen(II)-Ionen und gehen in Lösung | + | Oxidation: |
| + | An der Eisenanode oxidieren Eisenatome zu Eisen(II)-Ionen und gehen in Lösung | ||
Fe(s) <math>\rightarrow</math> Fe<sup>2+</sup>(aq) + 2e<sup>-</sup> | Fe(s) <math>\rightarrow</math> Fe<sup>2+</sup>(aq) + 2e<sup>-</sup> | ||
| − | Die Elektronen wandern über den Verbraucher in die Kupferkathode, wo sie Oxonium-Ionen aus der sauren Lösung reduzieren | + | Reduktion |
| + | Die Elektronen wandern über den Verbraucher in die Kupferkathode, wo sie Oxonium-Ionen aus der sauren Lösung reduzieren | ||
2H<sub>3</sub>O<sup>+</sup>(aq) + 2e<sup>-</sup> + <math>\rightarrow</math> 2H<sub>2</sub>O(l) + H<sub>2</sub>(g) | 2H<sub>3</sub>O<sup>+</sup>(aq) + 2e<sup>-</sup> + <math>\rightarrow</math> 2H<sub>2</sub>O(l) + H<sub>2</sub>(g) | ||
| + | |||
| + | Redoxreaktion: | ||
| + | |||
| + | Fe(s) + 2H<sub>3</sub>0<sup>+</sup>(aq) <math>\rightarrow</math> Fe<sup>2+</sup>(aq) + 2H<sub>2</sub>0(l) + H<sub>2</sub> | ||
Version vom 15. Dezember 2009, 13:59 Uhr
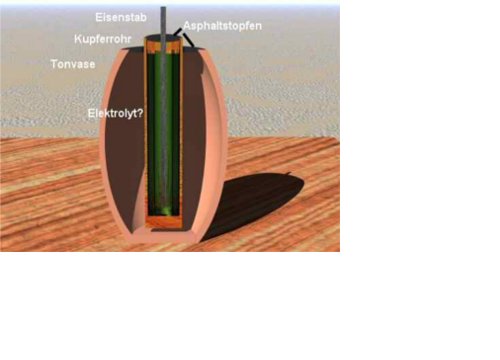
Die Bagdad-Batterie, auch Batterie der Parther genannt, ist der älteste bekannte Fund von einem galvanischem Element. Es handelt sich hierbei um ein im Jahre 1936 von Wilhelm König entdecktes Tongefäß, welches schon vor 2000 Jahren als Batterie gedient haben könnte. Bei Ausgrabungen an dem Hügel Khujut Rabuah in der Nähe von Bagdad, Irak, stieß er auf die als erste Batterie bekannte Konstruktion.
Es handelt sich hierbei um ein galvanisches Element mit einer Kupfer, und einer Eisenelektrode. Da man nicht weiß, was für ein Elektrolyt benutzt wurde, geht man von der Benutzung von Fruchtsäuren aus.
Reaktionen:
Oxidation: An der Eisenanode oxidieren Eisenatome zu Eisen(II)-Ionen und gehen in Lösung
Fe(s) 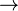 Fe2+(aq) + 2e-
Fe2+(aq) + 2e-
Reduktion Die Elektronen wandern über den Verbraucher in die Kupferkathode, wo sie Oxonium-Ionen aus der sauren Lösung reduzieren
2H3O+(aq) + 2e- + 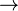 2H2O(l) + H2(g)
2H2O(l) + H2(g)
Redoxreaktion:
Fe(s) + 2H30+(aq) 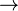 Fe2+(aq) + 2H20(l) + H2
Fe2+(aq) + 2H20(l) + H2