Galvanische Zelle: Unterschied zwischen den Versionen
| (12 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | Der italienische Arzt und Naturforscher Luigi Galvani legte mit seinen Experimenten den Grundstock für die Entwicklung elektrochemischer Zellen, die später durch Alessandro Volta weiterentwickelt wurden. Er war der Namensgeber der Basis | + | Der italienische Arzt und Naturforscher Luigi Galvani legte mit seinen Experimenten den Grundstock für die Entwicklung elektrochemischer Zellen, die später durch [[Voltasche Säule|Alessandro Volta]] weiterentwickelt wurden. Er war der Namensgeber der Basis aller Batterien und Akkumulatoren, der '''galvanischen Zelle'''.<br /> |
| − | In einer galvanische Zelle läuft die Umkehrreaktion der Elektrolyse, eine Redoxreaktion ab, die durch die Potenzialdifferenz zwischen 2 Elektoden entsteht. Es | + | In einer galvanische Zelle läuft die Umkehrreaktion der [[Elektrolyse und Faraday-Gesetze|Elektrolyse]], eine Redoxreaktion ab, die durch die [[Quantitative Redoxreihe|Potenzialdifferenz]] zwischen 2 Elektoden entsteht. Es fließt ein elektrischer Strom.<br /> |
| Zeile 8: | Zeile 8: | ||
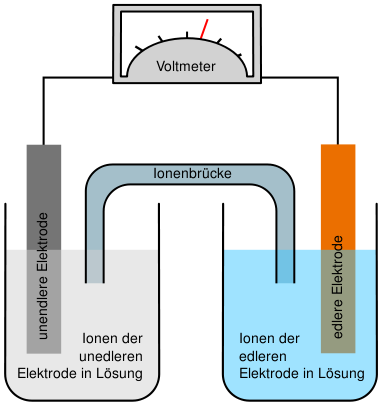
| − | Eine galvanische Zelle besteht aus 2 Halbzellen, die beide eine metallische Lösung und das selbe Metall, als Elektrode, beinhalten. In diesen von einander abgetrennten Räumen laufen die Oxidation und die Reduktion ab. Die beiden Teile des galvanischen | + | Eine galvanische Zelle besteht aus 2 Halbzellen, die beide eine metallische Lösung und das selbe Metall, als Elektrode, beinhalten. In diesen von einander abgetrennten Räumen laufen die [[Donator-Akzeptor-Reaktionen|Oxidation]] und die [[Donator-Akzeptor-Reaktionen|Reduktion]] ab. Die beiden Teile des galvanischen Elementes sind durch einen Ionenleiter, ein Diaphragma (eine Fritte), eine Elektrolytbrücke oder eine semipermeable Wand mit einander verbunden, durch die die Ionen von der einen Lösung in die andere wandern und so die Elektronen transportieren ([[Elektrische Leitfähigkeit von wässrigen Lösungen]]). |
Die beiden Elekroden wiederum sind noch mit einem Elektronenleiter mit einander verbunden.<br /> | Die beiden Elekroden wiederum sind noch mit einem Elektronenleiter mit einander verbunden.<br /> | ||
| Zeile 14: | Zeile 14: | ||
Um die maximale Spannung einer galvanischen Zelle zu messen, schaltet man ein Voltmeter parallel zur galvanischen Zelle.<br /> | Um die maximale Spannung einer galvanischen Zelle zu messen, schaltet man ein Voltmeter parallel zur galvanischen Zelle.<br /> | ||
| + | |||
| + | |||
| + | |||
| + | == Das Daniell-Element<br /> == | ||
| + | |||
| + | |||
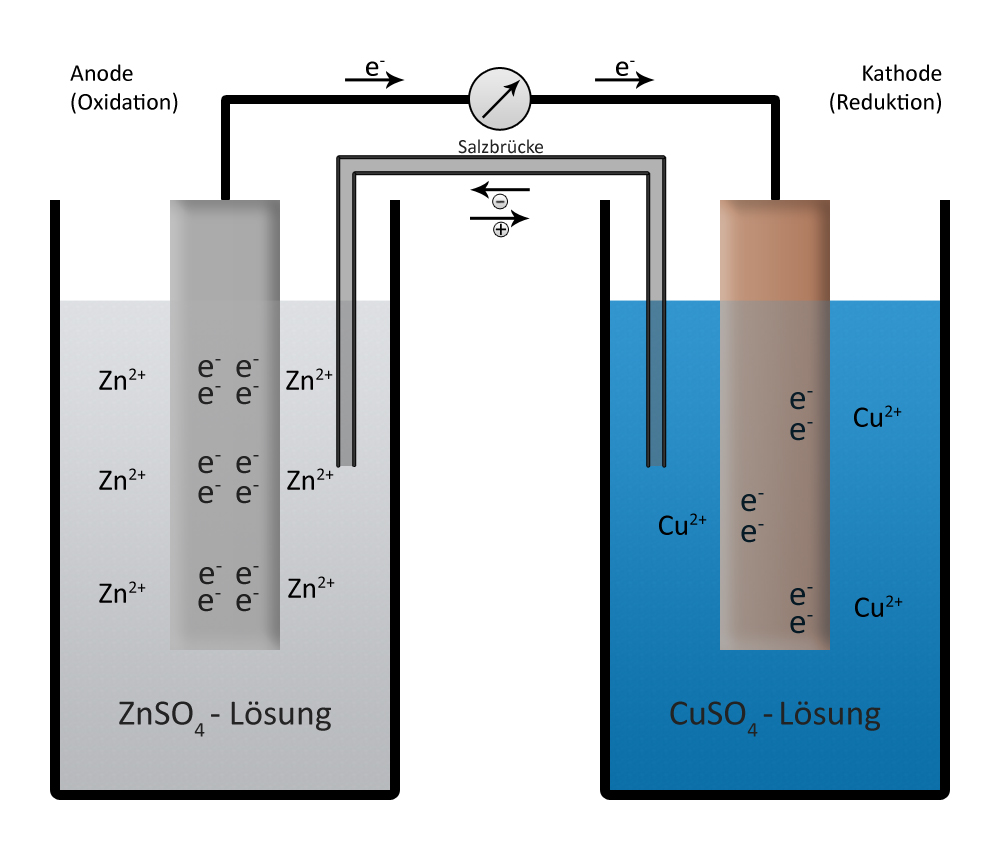
| + | Um die Reaktionen in einer galvanischen Zelle zu verdeutlichen, nehmen wir als Beispiel das '''Daniell-Element''', benannt nach dem englischen Physiker und Chemiker John Frederic Daniell, der mit seiner Erfindung eine spezielle galvanische Zelle entwickelte. | ||
| + | |||
| + | Die 2 Halbzellen des Daniell-Element bestehen aus den [[Redoxreihe der Metalle|korrespondierenden Redoxpaaren]] | ||
| + | |||
| + | Zn(s) <-> Zn<sup>2+</sup>(aq) + 2e<sup>-</sup> | ||
| + | und | ||
| + | Cu(s) <-> Cu<sup>2+</sup> + 2e<sup>-</sup> | ||
| + | |||
| + | Baut man nun das Daniell-Element so auf, wie es im Aufbau der Galvanischen Zelle beschrieben ist, | ||
| + | |||
| + | [[Bild:Daniell-Element.jpg]] | ||
| + | |||
| + | fließen Elektronen von der Zink-Anode zur Kupfer-Kathode, es entsteht ein elektrischer Strom. | ||
| + | Der Strom kann nur fließen, wenn zwischen den beiden Elekroden eine Potentialdifferenz, also eine Spannung, besteht. | ||
| + | In einem Daniell-Element beträgt die Spannung immer ''U'' = 1,1 V. | ||
| + | |||
| + | |||
| + | To be continued... | ||
Aktuelle Version vom 30. Mai 2010, 21:10 Uhr
Der italienische Arzt und Naturforscher Luigi Galvani legte mit seinen Experimenten den Grundstock für die Entwicklung elektrochemischer Zellen, die später durch Alessandro Volta weiterentwickelt wurden. Er war der Namensgeber der Basis aller Batterien und Akkumulatoren, der galvanischen Zelle.
In einer galvanische Zelle läuft die Umkehrreaktion der Elektrolyse, eine Redoxreaktion ab, die durch die Potenzialdifferenz zwischen 2 Elektoden entsteht. Es fließt ein elektrischer Strom.
Aufbau einer galvanischen Zelle
Eine galvanische Zelle besteht aus 2 Halbzellen, die beide eine metallische Lösung und das selbe Metall, als Elektrode, beinhalten. In diesen von einander abgetrennten Räumen laufen die Oxidation und die Reduktion ab. Die beiden Teile des galvanischen Elementes sind durch einen Ionenleiter, ein Diaphragma (eine Fritte), eine Elektrolytbrücke oder eine semipermeable Wand mit einander verbunden, durch die die Ionen von der einen Lösung in die andere wandern und so die Elektronen transportieren (Elektrische Leitfähigkeit von wässrigen Lösungen).
Die beiden Elekroden wiederum sind noch mit einem Elektronenleiter mit einander verbunden.
Um die maximale Spannung einer galvanischen Zelle zu messen, schaltet man ein Voltmeter parallel zur galvanischen Zelle.
Das Daniell-Element
Um die Reaktionen in einer galvanischen Zelle zu verdeutlichen, nehmen wir als Beispiel das Daniell-Element, benannt nach dem englischen Physiker und Chemiker John Frederic Daniell, der mit seiner Erfindung eine spezielle galvanische Zelle entwickelte.
Die 2 Halbzellen des Daniell-Element bestehen aus den korrespondierenden Redoxpaaren
Zn(s) <-> Zn2+(aq) + 2e- und Cu(s) <-> Cu2+ + 2e-
Baut man nun das Daniell-Element so auf, wie es im Aufbau der Galvanischen Zelle beschrieben ist,
fließen Elektronen von der Zink-Anode zur Kupfer-Kathode, es entsteht ein elektrischer Strom. Der Strom kann nur fließen, wenn zwischen den beiden Elekroden eine Potentialdifferenz, also eine Spannung, besteht. In einem Daniell-Element beträgt die Spannung immer U = 1,1 V.
To be continued...