Elektrophile Addition
Bei der elektrophilen Addition handelt es sich wie der Name schon sagt um eine Additionsreaktion, die bevorzugt an Doppelbindungen stattfindet.
Sie ist die typische Reaktion an Alkenen und besitzt eine hohe Praxisrelevanz für die Herstellung von Polymeren.
Reaktionsmechanismus
Grundlage der Reaktion sind hier ein Alken und ein polarisierbares Molekül, dass als Elektrophil fungieren kann.
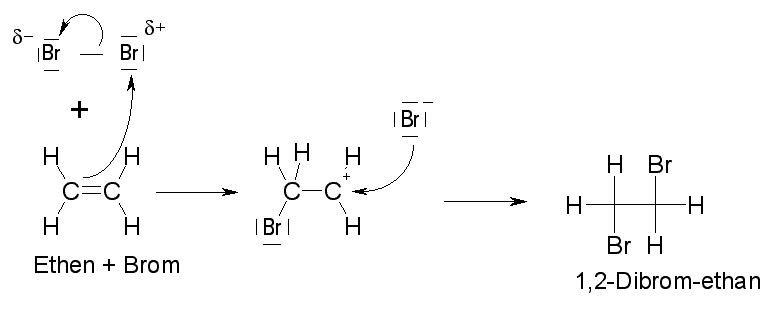
Auch elektrisch positiv geladene Teilchen stellen extrem starke Elektrophile dar. Im folgenden Beispiel reagieren Brom und Ethen:
Im ersten Schritt nähert sich das Elektrophil an und wird aufgrund der hohen Elektronendichte an der Doppelbindung polarisiert. Es entsteht ein pi-Komplex.
Im folgenden Schritt wird die Bindung des Elektrophils heterolytisch gespalten und das positiv geladene Bromid-Ion bildet mit dem Ethen ein cylisches Bromonium-Iom.
Dabei verbleibt die positive Ladung beim Brom-Atom innerhalb des Moleküls.
Nun erfolgt ein Rückseitenangriff des negativ geladenen Bromid-Ions. Eine Bindung klappt zum positiv geladenen Brom-Atom um und stellt einen Ladungsausgleich her.
Die dabei entstehende positive Ladung am Kohlenstoffatom wird durch die Elektronen des zweiten angreifenden Bromid-Ions ausgeglichen. Insgesamt stellt dieser Schritt eine
nucleophile Addition dar. Da aber die Annäherung im ersten Schritt der langsamste Elementarprozess ist, gibt dieser auch den Namen der Reaktion an.
Beeinflussende Faktoren
Die Geschwindigkeit der elektrophilen Addition hängt von zahlreichen Faktoren ab. Die wohl größte Rolle spielen dabei induktive Effekte. Generell kann man sagen,
dass Substituenten mit +I-Effekt eine beschleunigende Wirkung auf die Reaktion zeigen. Dies ist möglich, da sie das Tradukt stabilisieren und die Aktivierungsenergie
der Reaktion so herabsetzen. Umgekehrt sorgen Substituenten wie das Chlor-Gruppen, die einen -I-Effekt aufweisen und somit die Elektronendichte nahe der Doppelbindung
senken dafür, dass die Reaktivität sinkt.
Der zweite Punkt ist die Substratstruktur. Moleküle, bei denen aufgrund komplizierter Substituenten der Zugang für die relativ großen Elektrophile wie Halogene erschwert wird,
gehen kaum elektrophile Additionen ein. Die sterische Hinderung macht es einfach unmöglich, nahe genug an die Doppelbindung heranzukommen.
Aber auch das Lösungsmittel spielt eine Rolle. Die Reaktion verläuft nämlich über zahlreiche ionische Zwischenstufe und wird daher von polaren Lösungsmitteln begünstigt.
Hierbei ist lediglich zu beachten, dass andere nucleophile Teilchen (wie Wassermoleküle) das cyclische Bromonium-Ion abfangen können und beispielsweise Alkohole entstehen können.
Spezialfälle
Neben der "typischen" Halogenierung von Alkenen bietet die elektrophile Addition noch eine große Palette von wichtigen Reaktionen.
Die Hydrohalogenierung, die Hydratisierung, die Hydrierung oder die Polymerisation sind weitere Möglichkeiten diesen Mechanismus zu nutzen.