Massenwirkungsgesetz und chemisches Gleichgewicht
Das chemische Gleichgewicht beschreibt einen Zustand, den reversible (umkehrbare) Reaktionen (in einem geschlossenem System) nach einer bestimmten Zeit annehmen (abhängig u.a. von Temperatur, Anfangskonzentration, Druck etc.). Wenn sowohl auf der Edukt-, als auch der Produktseite keine Veränderung der Konzentration erkennbar ist, so ist dieser Zustand erreicht. Das heißt allerdings nicht, dass die Reaktion nicht mehr stattfindet. Es handelt sich genaugenommen um den Ausgleich von Hin- und Rückreaktionsrate, so dass genausoviele Teilchen von der Eduktseite zur Produktseite reagieren, wie zurück. Man spricht hierbei auch von einem dynamischem Gleichgewicht.
Das Massenwirkungsgesetz stellt beim chemischen Gleichgewicht den Zusammenhang der Konzentrationen von Edukt- und Produktseite her. Für eine allgemeine Reaktionsgleichung aA + bB -> dD + eE lautet die Formel für das Massenwirkungsgesetzt:
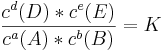
K ist die gesuchte Gelichgewichtskonstante, an der man erkennen kann, auf welcher Seite das Gleichgewicht liegt. Ist K klein (K < 1), so liegt das Gleichgewicht auf der Eduktseite, ist K groß (K > 1), so liegt es auf der Produktseite.

