Säure-Base-Titration
Unter einer Titration versteht man die Umsetzung eines bekannten Stoffes, dessen Konzentration unbekannt ist, in einer gezielten chemischen Reaktion mit der Maßlösung, deren Konzentration genau bekannt ist. Die Titration ist also ein Verfahren zur Bestimmung der Konzentration einer unbekannten Lösung. Das Volumen der verbrauchten Maßlösung wird gemessen und damit die unbekannte Konzentration der Probelösung berechnet. Die gemessen Werte kann man graphisch in einer sog. Titrationskurve darstellen.
Um die Konzentration der unbekannten Lösung nach der Titration zu bestimmen, wird zuerst das Verhältnis von Säure/Base bestimmt. Normalerweise beträgt das stöchiometrische Verhältnis 1:1. Mit dieser Annahme wird auch die Musterrechnung gelöst. Um das Verhältnis zu bestimmen, muss die Reaktionsgleichung der Titration bestimmt werden. Da am Äquivalenzpunkt n(Säure) = n(Lauge) gilt:
c(Säure)*V(Säure) = c(Base)*V(Base)
Drei der vier Größen sind nach der Titration bekannt (Annahme:c(Säure) = unbekannt):
c(Säure) = c(Base)*V(Base)
V(Säure)
Charakteristische Punkte einer Titrationskurve:
Bei den Koordinatensystemen, in die die Titrationskurven gezeichnet werden, wird die Menge der Lösung mit der bekannten Stoffmengenkonzentration gegen den gemessenen pH-Wert aufgetragen. Das heißt auf der x-Achse wird das Volumen der Lösung die zu der zu titrierenden Lösung hinzugegeben wird, eingetragen und auf der y-Achse wird der dem entsprechende pH-Wert eingetragen.
Anfangspunkt: Der Anfangspunkt der Titrationskurve liegt immer bei einem Volumen von 0ml an hinzugegebener Lösung (x-Wert) doch der pH-Wert kann immer ein anderer sein (y-Achse), je nachdem, ob die zu titrierende Lösung eine Säure oder Base ist und ob diese stark oder schwach ist.
Äquivalenzpunkt: Der Äquivalenzpunkt, der theoretische Endpunkt der Titration, ist der Punkt, an dem die Menge des zugesetzten Titranten der Menge an verbrauchtem Analyt entspricht. Mathematisch ist der Äquivalenpunkt der Wendepunkt der Kurve.
Neutralpunkt: Der Neutralpunkt ist der Punkt der Neutralisationsreaktion, an dem die Menge an OH--Ionen gleich der Menge an H+-Ionen ist, d.h. an dem der pH-Wert den Wert 7 hat.
Halbäquivalenzpunkt:Der Halbäquivalenzpunkt existiert bei Titrationen starker Säuren mit starken Basen nicht. An diesem Punkt ist der pH-Wert gleich dem pKs-Wert bei der Titration einer schwachen Säure mit einer starken Base. Er gibt ebenso, wie der Äquivalenzpunkt einen weiteren Wendepunkt des Graphens an.
Endpunkt: Der Endpunkt der Titrationskurve ist, wie der Name schon sagt, der Punkt an dem die Zugabe der Lösung mit der bekannten Konzentration abgebrochen wird. Im Allgemeinen nimmt der pH-Wert nach dem Überschreiten des Äquivalenzpunktes nicht mehr stark zu.
Verschiedene Titrationskurven bei der pH-metrischen Titration
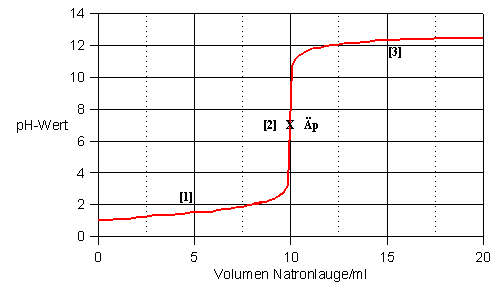
Titrationskurve einer starken Säure mit einer starken Base
Bei der Titration einer starken Säure mit einer starken Base sieht die Titrationskurve wie folgt aus:
Der Graph beginnt bei einem sehr geringen pH-Wert, weil die Säure, sehr stark ist und dem entsprechend einen sehr niedrigen pH-Wert hat. Der Graph steigt nun erst sehr langsam an, bis es zum pH-Sprung kommt. Dann steigt der Graph wieder nur sehr langsam an, nur dieses mal bei einem sehr hohen pH-Wert. Ein Halbäquivalenpunkt ist nicht vorhanden. Bei der Titration einer starken Säure mit einer starken Base liegt der Äquivalenzpunkt genua bei pH 7, weil dort sämtliche H3O+-Ionen mit den OH--Ionen aus der hinzugegebenen Base reagiert haben.
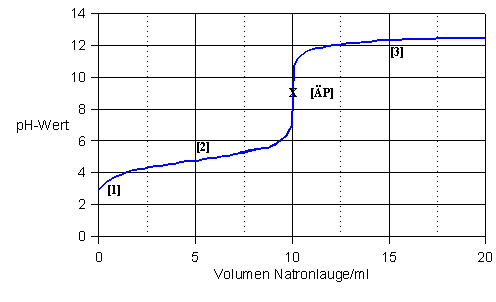
Titrationskurve einer schwachen Säure mit einer starken Base
Der Angfangspunkt der Titrationskurve liegt hier höher als bei der oben beschriebenen Titration, weil es sich hier um eine schwache Säure handelt, die titriert wird. Aus diesem Grund fällt auch der pH-Sprung, zwar immer noch deutlich aber weniger groß aus und der Äquivalenzpunkt ist nciht mehr gleich dem Normalpunkt. Bei dieser Titration ist allerdings ein Halbäquivalenzpunkt vor dem Äquivalenzpunkt vorhanden.
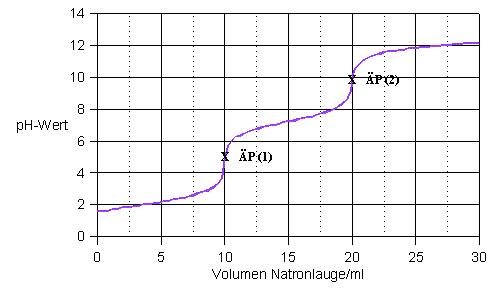
Titrationskurve einer zwieprotonigen Säure mit einer starken Base
Es gibt auch Titrationskurven, die zwie pH-Sprünge aufweisen. Dies kommt zu Stande, wenn eine zweiprotonige Säure titriert wird. In diesem Fall gibt es einen verhältnismäßig kleine ersten pH-Sprung und einen zweiten größeren. Der Halbäquivalenpunkt liegt zwischen den beiden Punkten und gibt den pKs-Wert der Säure an, die bereits ein H abgespalten hat.